上海细胞库
人源细胞系| 稳转细胞系| 基因敲除株| 基因点突变细胞株| 基因过表达细胞株| 重组细胞系| 猪的细胞系| 马细胞系| 兔的细胞系| 犬的细胞系| 山羊的细胞系| 鱼的细胞系| 猴的细胞系| 仓鼠的细胞系| 狗的细胞系| 牛的细胞| 大鼠细胞系| 小鼠细胞系| 其他细胞系|

| 规格 | 价格 | 库存 |
|---|---|---|
| 0.1ml | ¥ 2800 | 10 |
| 1mg | ¥ 2800 | 10 |
| 5mg | ¥ 10000 | 10 |
| 25mg | ¥ 40000 | 10 |
| 产品编号 | 产品名称 | 产品包装 | |
| T100035-0.1ml | Senescence-Tracker™衰老细胞近红外荧光探针 | 10mM×0.1ml | |
| T100035-1mg | Senescence-Tracker™衰老细胞近红外荧光探针 | 1mg | |
| T100035-5mg | Senescence-Tracker™衰老细胞近红外荧光探针 | 5mg | |
| T100035-25mg | Senescence-Tracker™衰老细胞近红外荧光探针 | 25mg |
衰老细胞近红外荧光探针(Senescence-Tracker™ Near-infrared, Senescence-Tracker™ NIR),是一种新型的可用于体内或体外高亮度、高稳定性、高特异性、高生物安全性地检测衰老细胞(Senescent cells, SnCs)的近红外荧光探针。Senescence-Tracker™衰老细胞近红外荧光探针能够被衰老细胞特异性表达的β-半乳糖苷酶(β-galactosidase, β-gal)特异识别并快速酶解,产生强烈的近红外荧光信号。
本探针中国授权专利号为ZL202211569064.4,相关研究成果发表在国际衰老研究领域著名期刊Aging Cell (2023. 22(8):e13896)。
绝大多数正常细胞被认为仅具备有限的分裂能力,在停止分裂后就会逐渐进入衰老(Senescence)状态。此时细胞仍然是存活的,但细胞的基因和蛋白的表达谱发生了巨大改变。衰老细胞不能再发生有丝分裂,并且衰老细胞的细胞周期分布也比较特殊,不同于某些损伤诱导的细胞休眠(Dormancy),也不同于细胞生长接触抑制产生的细胞静默(Quiescence)。细胞衰老被认为是生物体抑制肿瘤的一种方式,但累积的衰老细胞同时也是生物体老化(Aging)的直接原因[2,3]。追踪衰老细胞通常依赖于检测衰老细胞的标记物和表型特征,如细胞周期抑制蛋白p16和p21、衰老相关分泌表型(Senescent associated secretory phenotype, SASP)和衰老相关的β-gal (Senescence-associated β-gal, SA-β-gal) [4-6]。其中,SA-β-gal是最为广泛接受和使用的细胞衰老生物标志物。
Senescence-Tracker™衰老细胞近红外荧光探针(Senescence-Tracker™ NIR),又称XZ1208,CAS号为3026598-16-0,分子式为C34H29N3O9,分子量为623.62,主要由3部分结构组成:DCM (Dicyanomethylene-4H-pyran)-衍生的NIR荧光团、β-Gal残基和自裂解连接子(Self-immolative linker)。Senescence-Tracker™ NIR进入衰老细胞后,糖苷键被细胞内β-gal快速切割断裂,随后Senescence-Tracker™ NIR 的自裂解部分转化为亚甲基苯醌(Quinone methides, QMs),并最终激活NIR荧光团,产生强烈的荧光信号,最大激发波长为490 nm,最大发射波长为760nm,可根据仪器的差异适当优化波长(可参照图1优化)。
本探针特异性强、灵敏度高。本探针仅染色衰老细胞,不会染色衰老前的细胞(Presenescent cells)、静止期细胞(Quiescent cells)和大部分永生细胞(Immortal cells);本探针在非衰老细胞和年轻小鼠中几乎检测不到荧光,但在衰老细胞和老年小鼠中可以检测到显著的荧光信号
本探针可应用于活体成像,组织穿透能力强,具有更低的本底荧光。常规的β-Gal荧光成像探针激发和发射的波长主要位于可见光范围,生物组织的吸收、散射以及自发荧光干扰导致背景信号高、组织穿透力差,限制了这些探针体内成像的应用。而本探针的发射波长位于近红外(Near-infrared, NIR)窗口,具有很好的组织穿透力、较低的背景荧光和生物损伤。
本探针稳定性好、追踪间长、工作浓度低。经测试,在多种方式诱导衰老的人胚胎肺成纤维细胞(Human embryonic lung fibroblasts, HELF)和衰老的人真皮成纤维细胞(Human dermal fibroblasts, HDF)中,本探针染色细胞后约2小时,就可以迅速被切割并产生明显的荧光,荧光信号约24小时后达到峰值,48小时仍能基本保持稳定;10μM的本探针处理HELF和HDF细胞48小时后换液,6天后细胞内仍可检测到荧光信号;低至0.5μM的本探针即可有效标记衰老细胞;在小鼠模型中,尾静脉注射低至5μM的本探针100μl,即可实现活体内实时检测衰老程度,探针在1-2小时内能被完全激活,并显示出非常强的荧光信号,标记效应可持续至少6天[1]。
本探针生物安全性高。经测试本探针在体外和体内模型,特别是多种衰老和衰老相关疾病模型(衰老、衰老相关纤维化、创面愈合)中无明显毒性,可长期且安全地追踪衰老细胞。用高达50μM的本探针孵育HELF和HDF细胞3天,细胞活力未见影响;给小鼠注射高剂量(10μM)的本探针,并在第7天检测了血细胞组成、血浆生化指标和组织形态。结果显示,经本探针处理的小鼠各项指标与对照组均无差异[1]。
本探针操作简单,使用方便。常规的β-gal检测法方法是基于β-gal催化X-gal (5-Bromo-4-chloro-3-indolyl β-D-galactopyranoside)生成深蓝色产物,如的细胞衰老β-半乳糖苷酶染色试剂盒、溶酶体β-半乳糖苷酶染色试剂盒。细胞衰老β-半乳糖苷酶染色试剂盒方法注意事项繁多、实验器具要求高、操作相对复杂,并无法进行活细胞或活体检测。其它一些针对β-gal检测方法虽然简化了操作,使用更为便捷,但仍需要事先固定或者裂解细胞。而本探针可通过被动运输穿过细胞膜,使用时,细胞水平只需进行简单共孵育培养,小鼠模型只需进行尾静脉注射即可,操作非常简单,无需对细胞进行固定或裂解,可实时检测活细胞的衰老或活体小鼠中的衰老细胞。
Senescence-Tracker™ NIR对衰老细胞和小鼠的染色、成像效果参考图1。
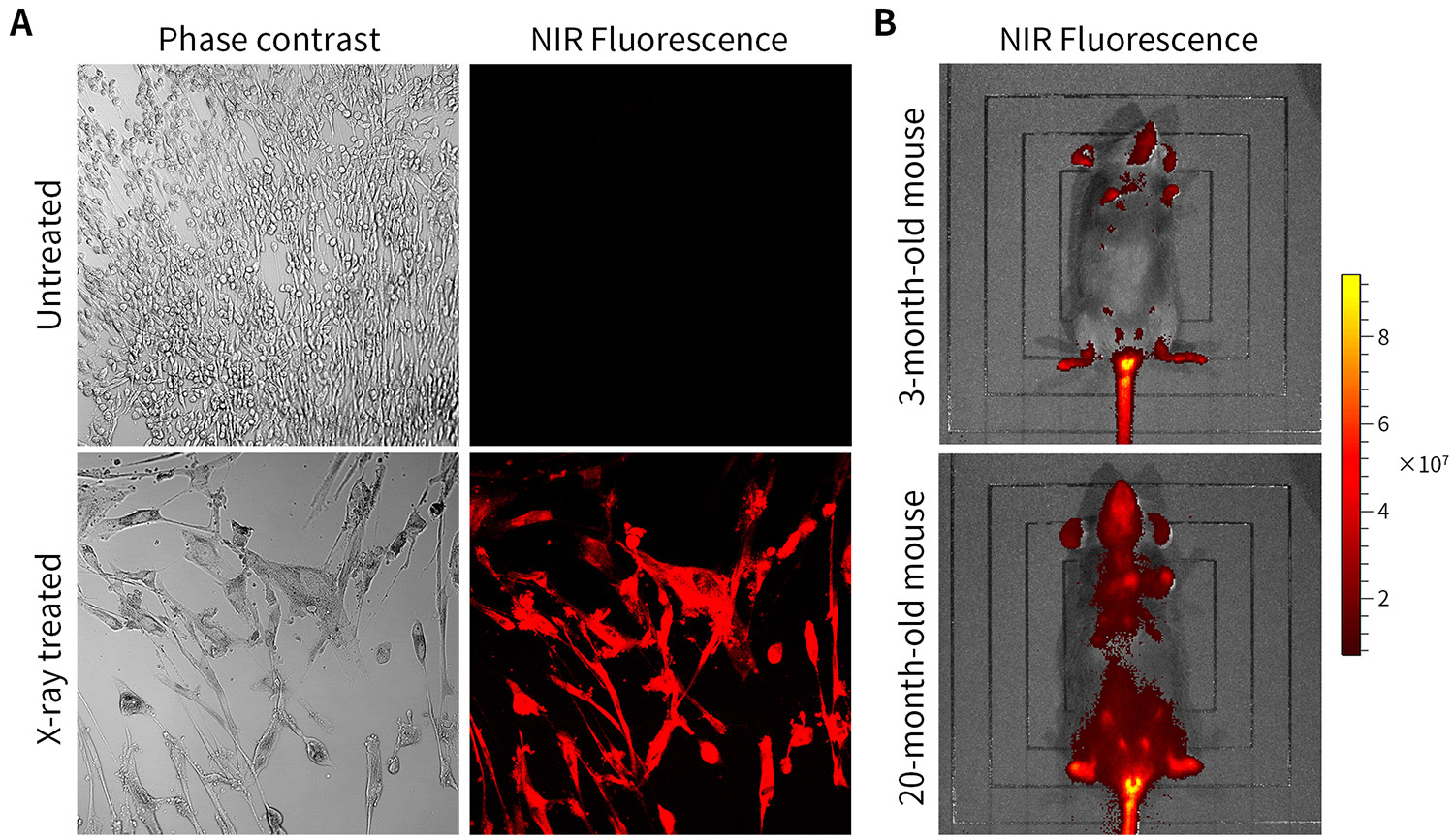
图1.衰老细胞近红外荧光探针对体外和体内衰老细胞的染色效果图。正常(Untreated)和经X光照射(X-ray treated)诱导衰老的HELF细胞(人胚胎肺成纤维细胞)的检测效果见图A (激发波长595nm,检测波长650-701nm);3个月龄年轻小鼠及20个月龄衰老小鼠的成像效果见图B (激发波长436-500nm,检测波长570-700nm)。可根据仪器的差异适当优化波长。实际检测效果会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。
本探针提供10mM溶液装和粉末装。10mM溶液装配制在DMSO中,每0.1ml可以配制约100ml Senescence-Tracker™ NIR染色工作液(10μM);每1mg粉末可以配制约160ml Senescence-Tracker™ NIR染色工作液(10μM)。
本探针为专利化合物,中国授权专利号为ZL202211569064.4,严禁侵权。如使用本探针发表论文等,请引用:Aging Cell. 2023. 22(8):e13896
本探针已经在衰老细胞(肺和皮肤来源的成纤维细胞)、自然衰老小鼠、辐照小鼠和皮肤损伤等模型中进行过验证。在应用于其它衰老细胞相关的模型时,需要进行相应的优化以验证探针效果。
须使用可以检测近红外荧光探针的激光共聚焦显微镜、荧光显微镜等荧光检测设备用于衰老细胞的检测;须使用可以检测近红外荧光探针的活体成像设备进行小鼠等活体的衰老细胞检测。
初次使用时可适当分装,避免反复冻融。
对于微量的液体,每次使用前先离心数秒钟,使液体充分沉降到管底。
对于细胞染色,建议染色完成后立即进行观测;如果条件限制,请避光4℃保存,并在24小时内进行检测,放置时间过久可能会导致荧光部分猝灭。
荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.Senescence-Tracker™ NIR储存液(10mM)的配制:
每1mg Senescence-Tracker™ NIR粉末加入160μl的无水DMSO (ST038),充分溶解后,得到浓度为10mM的Senescence-Tracker™ NIR储存液。适当分装后避光保存于-20ºC或更低温度。
注:本探针10mM溶液装无须配制,可直接用于Senescence-Tracker™ NIR染色工作液的配制。
2.Senescence-Tracker™ NIR染色工作液(10μM)或注射液(100μM)的配制:
a.染色工作液(10μM)的配制(用于细胞染色):
(a)根据样品数量及每个样品所需的Senescence-Tracker™ NIR染色工作液的体积,取一定量Senescence-Tracker™ NIR储存液(10mM)按照1:1000的比例加入到细胞培养液(含10% FBS)中,使最终浓度为10μM。例如取1µl Senescence-Tracker™ NIR储存液(10mM)加入到1ml细胞培养液(含10% FBS)中,混匀后即为1ml 10μM的Senescence-Tracker™ NIR染色工作液。
(b)Senescence-Tracker™ NIR染色工作液(10μM)须现配现用。
注:染色工作液中Senescence-Tracker™ NIR的浓度可以根据实际情况进行适当调整。为降低非特异性荧光染色,在染色效果可以接受的范围内,建议尽量使用较低浓度的Senescence-Tracker™ NIR。
b.注射液(100μM)的配制(用于小鼠等注射):
(a)按照1:2:97的比例混合Senescence-Tracker™ NIR储存液(步骤1配制)、2% Tween-80和生理盐水(ST341),例如取10μl Senescence-Tracker™ NIR储存液和20μl 2% Tween-80加入970μl生理盐水中,混匀即得1ml 100μM的Senescence-Tracker™ NIR注射液。
(b)Senescence-Tracker™ NIR注射液(100μM)须现配现用。
3.对于悬浮细胞:
a.细胞按照实验设计进行一定处理后,计数。取适当细胞600×g室温离心5分钟,弃上清,加入适当体积的Senescence-Tracker™ NIR染色工作液重悬细胞,使细胞密度为100万-2000万/ml。
b.细胞培养箱中37ºC孵育24小时,不同的细胞最佳孵育时间不同。以24小时作为初始孵育时间,根据实际检测效果对孵育时间进行适当优化以得到更佳的检测效果。
c.37ºC孵育结束后,600×g 4ºC离心3-4分钟,沉淀细胞。弃上清,注意尽量不要吸除细胞。
d.加入1ml PBS洗涤细胞,600×g 4ºC离心3-4分钟,沉淀细胞,弃上清。重复洗涤2次。
e.再用适量PBS重悬后,用荧光显微镜或激光共聚焦显微镜观察,也可以用荧光酶标仪检测或流式细胞仪分析。
注:如果需要在载玻片或盖玻片上固定悬浮细胞,可选用Poly-D-lysine/多聚赖氨酸(ST508)处理载玻片或盖玻片。
4.对于贴壁细胞:
本步骤以6孔板为例。其它孔板检测试剂的用量参考6孔板的用量进行适当调整。
a.吸除培养液,PBS洗涤1次。
b.每孔加入1ml Senescence-Tracker™ NIR染色工作液。细胞培养箱中37ºC孵育24小时,不同的细胞最佳孵育时间不同。以24小时作为初始孵育时间,根据实际检测效果对孵育时间进行适当优化以得到更佳的效果。
c.37ºC孵育结束后,吸除上清,用PBS洗涤3次。
d.每孔加入1ml PBS,荧光显微镜或激光共聚焦显微镜下观察。HELF细胞的检测效果见图1A。
注1:如果希望采用流式细胞仪检测,可以收集细胞,PBS重悬后进行检测。
注2:如果细胞贴壁不太好,可沿着孔板壁缓慢加入溶液,然后轻轻混匀,以避免细胞被冲散。
5.对于小鼠:
a.每只小鼠尾静脉注射100μl Senescence-Tracker™ NIR注射液(100μM)。按照小鼠约2ml血液来计算,Senescence-Tracker™ NIR在血液中的粗略终浓度约为5μM。
b.24小时后麻醉小鼠并进行活体成像 (In vivo imaging systems, IVIS)。3个月年轻小鼠及20个月衰老小鼠的成像效果见图1B。
注:小鼠Senescence-Tracker™ NIR注射液的浓度通常可以在50-300μM范围内适当调整;体内的示踪时间可根据实验需要大致在1-6天内进行适当调整。
参考文献:
1.Hu L, Dong C, Wang Z, He S, Yang Y, et al. Aging Cell. 2023. 22(8):e13896.
2.Baker DJ, Childs BG, Durik M, Wijers ME, Sieben CJ, et al. Nature. 2016. 530(7589):184-9.
3.Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, et al. Nature. 2011. 479(7372):232-6.
4.Huang W, Hickson LJ, Eirin A, Kirkland JL, Lerman LO. Nat Rev Nephrol. 2022. 18(10):611-627.
5.Birch J, Gil J. Genes Dev. 2020. 34(23-24):1565-1576.
6.Itahana K, Campisi J, Dimri GP. Methods Mol Biol. 2007. 371:21-31.