上海细胞库
人源细胞系| 稳转细胞系| 基因敲除株| 基因点突变细胞株| 基因过表达细胞株| 重组细胞系| 猪的细胞系| 马细胞系| 兔的细胞系| 犬的细胞系| 山羊的细胞系| 鱼的细胞系| 猴的细胞系| 仓鼠的细胞系| 狗的细胞系| 牛的细胞| 大鼠细胞系| 小鼠细胞系| 其他细胞系|

| 规格 | 价格 | 库存 |
|---|---|---|
| 50次 | ¥ 1980 | 200 |
1. 含可见光和荧光染料,既可以用金属浴和水浴扩增用可见光肉眼判断结果,也可用荧光 PCR 仪进行实时荧光检测。
2. 内含的 dUTP-UNG 可防交叉污染。
3. 特异性比 RT-PCR 高,因为 RT-LAMP 扩增使用 4-6 条引物而不是两条。
4. 灵敏性可达 10 拷贝/反应以下(随引物而不同),故假阴性率更低。
只可用于科研,只可进行定性检测,不能用于定量检测。
| 成份 | 编号 | 塑料盒包装 |
| MMLV 逆转录酶(含 RI),200U/μL | 60905a | 50 μL(黄盖) |
| 4×RT Buffer(含 dNTP) | 60905b | 250 μL(白盖) |
| 5×荧光及可视化LAMP MagicMix | 200603a | 200 μL(绿盖) |
| Bst DNA 聚合酶 2.0(8U/uL) | 200403 | 50 uL (红盖) |
| RT-LAMP 阳性对照模板-引物混合物 | 130923a | 20 μL(黄盖) |
| 超纯水 | 100935 | 1mL(亮黄盖) |
| 使用手册 | 200603sc | 1 份 |
低温运输,-20℃保存,保存期限为一年
RT-LAMP 模板及 RT-LAMP 引物、PCR 级石蜡油(仅对使用金属浴或水浴者)。
准备工作:如果使用水浴锅或金属浴,需要在实验启动前打开并调到 60-65℃。如果用金属浴,还必须在孔中加水以填充金属孔和反应管间的空隙。金属浴和水浴温控远远不如PCR 仪器,所以使用前需要用阳性对照和阴性对照(水)做预实验确认可用。一、样品 RNA 的制备
1. 用自选方法纯化样品的 RNA,本试剂盒跟市场上大多数 RNA 提取试剂盒兼容。
2. 如果有 N 个样品,则至少需要做 N+2 个样品制备,包括一个制备阳性对照(制备时加入自备的跟要检测的靶分子相同的阳性对照模板,一起经历提取过程)和一个制备阴性对照(用水替代样品)。最后 N+2 个样品一起进行 RNA 提取操作,得到 N+2 个 RNA 样品。
二、合成 1st-strand cDNA
按下表配制 RT 反应体系:
| 成分 | 加入量 |
| 自备 RNA 模板总 RNA 或 poly(A) mRNA 或专一的 RNA 注意:RNA 样品不能有基因组 DNA 污染。 |
100-500 ng 10-500 ng 0.01pg-500ng |
| 自备引物 F3 | 1 μL |
| 4×RT Buffer(含 dNTP) | 5 μL |
| 自备 RNase-free 水 | 补水到 19 μL |
4. 70℃保温 5 分钟后立即冰浴。
5. 37℃保温 5 分钟。对富含二级结构的高 GC RNA 模板,可改成 45℃保温 5 分钟。
6. 加入 1μL (=200 U) MMLV 逆转录酶(含 RI),终体积为 20μL。
7. 42℃保温 60 分钟。
8. 70℃保温 10 分钟以终止反应,放置在冰上待用。合成的 cDNA 可以直接作为
LAMP 模板使用,不需要纯化。
三、 荧光及可视化 LAMP 扩增及检测(20μL 体系)
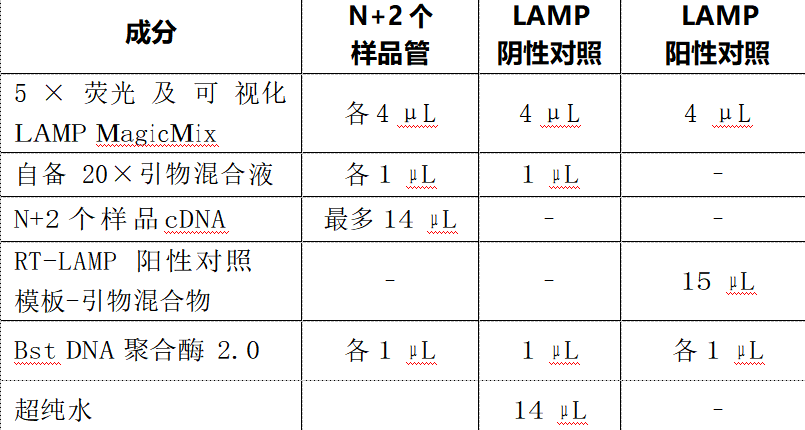
9. 反应设置:如果有 N+2 个 cDNA 样品,则最好设置 N+4 个LAMP 扩增,增加 LAMP
阴性对照和 LAMP 阳性对照各 1 个。在 N+4 个 0.2mL PCR 管中加入下列成分:
10. 混匀后进行扩增。由于本产品含双染料,可以根据实验室条件选择下列三种方式进行扩增和检测。
11. 如果使用PCR 仪、金属浴或水浴进行扩增,肉眼检测,则必须先在每个反应管中加 30 μL 自备的石蜡油,否则保温期间反应体系的水分会蒸发,影响反应效率(如果使用 PCR 仪器并开启热盖,则可以不加石蜡油)。60-65℃保温 90 分钟,肉眼观察管内液体颜色。
12。如果使用荧光定量 PCR 仪:设为 60-65℃保温 1 分钟/循环, 90 个循环,每分
钟在 FAM 通道采集一次荧光信号。
13. 如果使用PCR 仪、金属浴或水浴进行扩增,再使用 qPCR 仪进行终点法荧光读数: 则在扩增前和扩增后,分别在 qPCR 仪器上测荧光读数(温度设为 60-65℃,1 次循环,每次循环 1 分钟,在 FAM 通道采集一次荧光信号。注意:测荧光读数必须在 65℃进行)。扩增反应按 60-65℃,90 分钟进行。
四、 结果分析及解读
14. 如果是用普通PCR 仪器、水浴或金属浴进行的扩增,反应结束后只能肉眼判断结果。将反应管放置在白色背景(如白纸)前观察。扩增阳性对照管内反应液将呈现蓝色,无模板和无引物的阴性对照将呈浅蓝色。如果扩增阳性对照管内反应液不呈现蓝色,或无模板和无引物的阴性对照任何一个呈现蓝色,则说明试剂有问题,实验无效。请跟厂家联系。
15. 如果实验有效,则分析 N+2 个样品管的结果。如果样品管反应液的颜色接近扩增阳性对照管则说明有扩增,如果接近无模板和无引物的阴性对照,则说明无扩增。反应结果示例见左图(9 为阴性,10 为阳性)。
16. 如果是用荧光PCR 仪进行扩增,则可分析扩增曲线和 Ct。试剂盒提供的阳性对照的 Ct 将小于 60,如果大于 60,说明试剂可能失效,需跟厂家联系。无模板阴性对照和无引物阴性对照的 Ct 将大于 90。如果任何小于 90,则说明试剂或环境被污染,需重复实验或跟厂家联系。如果阳性对照和阴性对照 Ct 都在正常范围,则分析样品的 Ct。Ct 小于 60 的判断为阳性,大于 90 判为阴性,在 60-90 之间则需要重复检测。
17. 如果使用 PCR 仪、金属浴或水浴进行扩增,肉眼检测,再使用荧光定量 PCR 仪进行终点法荧光读数来判断阴阳性,则先比较阳性对照和阴性对照。阳性对照样品扩增后信号增幅应该超过 100%,阴性对照扩增后信号增幅应该低于 50%,否则实验无效,请与厂家联系。如果两个对照均有效,则比较样品扩增前后荧光读数的差值。如果扩增后荧光信号增幅低于 50%,则判断为阴性。如果荧光信号增幅高于 100%,则判断为阳性。荧光信号增幅在 50-100%之间的,则需要重测。
18. 当实时荧光检测和可视化检测同时用于判读结果时,如果彼此不一致,以实时荧光LAMP 的数据为准。一般可视化结果滞后实时荧光检测结果 20-30 分钟,也就是说,在 qPCR 仪上第 30 分钟时呈现阳性的样品,其反应液的颜色变化一般在第
50-60 分钟时才能观察到。