上海细胞库
人源细胞系| 稳转细胞系| 基因敲除株| 基因点突变细胞株| 基因过表达细胞株| 重组细胞系| 猪的细胞系| 马细胞系| 兔的细胞系| 犬的细胞系| 山羊的细胞系| 鱼的细胞系| 猴的细胞系| 仓鼠的细胞系| 狗的细胞系| 牛的细胞| 大鼠细胞系| 小鼠细胞系| 其他细胞系|

| 规格 | 价格 | 库存 |
|---|---|---|
| 25次 | ¥ 880 | 200 |
快速银染试剂盒(Fast Silver Stain Kit)是一种快速简单、可用于SDS-PAGE或非变性PAGE等蛋白银染的试剂盒。
本试剂盒也可以用于2D凝胶的银染,并且染色后和后续的质谱检测兼容。
本试剂盒只需一小时左右即可观察到蛋白条带,90分钟内可以完成2块凝胶的银染。
对于BSA蛋白,检测灵敏度可以达到0.3ng蛋白。(参考图1)
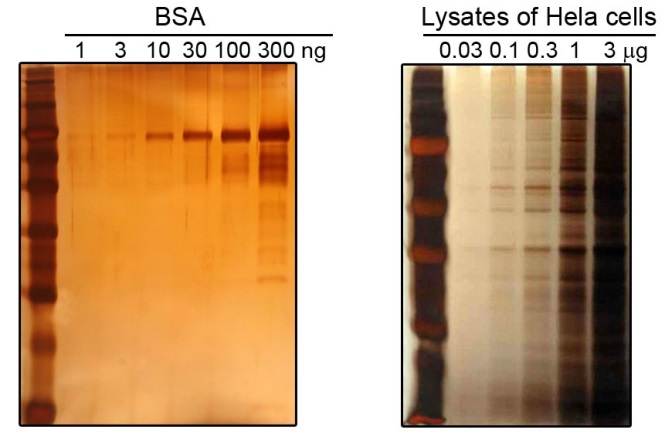
图1. 本试剂盒PAGE胶银染效果图。BSA(左图)和Hela细胞裂解液(右图)在SDS-PAGE后使用本试剂盒进行银染的效果图。最左侧泳道均为蛋白分子量标准。左图为获得较高的检测灵敏度,显色时间较长,已经产生了橙黄色的背景;右图显色时间较短,仅出现浅土黄色的背景。
无需使用有毒的甲醇。
本试剂盒可足够用于25块常规的8×10cm凝胶的银染。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| P0017S-1 | 银染增敏液(100X) | 26ml |
| P0017S-2 | 银溶液(100X) | 26ml |
| P0017S-3 | 银染基本显色液(5X) | 125ml×4 |
| P0017S-4 | 银染显色加速液(2000X) | 1.5ml |
| P0017S-5 | 银染终止液(20X) | 125ml |
| — | 说明书 | 1份 |
保存条件:
室温保存,一年有效。银溶液(100X)和银染显色加速液(2000X)需避光保存。
注意事项:
由于银染非常灵敏,操作时请注意尽量使用高纯度的水,并确保所使用的器皿非常清洁,最好使用洁净的玻璃器皿。操作时必须戴手套,避免皮肤和凝胶直接接触。
需自备乙醇、乙酸及Milli-Q级纯水或双蒸水。
下述使用说明中各种溶液的使用量适用于大小为8×10cm厚度为0.75-1mm的凝胶。对于更大的凝胶,各种溶液的使用量需按凝胶面积的比例放大,对于更厚的凝胶,作用时间需按照厚度的比例适当延长。
本说明书所指的室温为20-25℃,操作温度较低时由于溶液的扩散能力下降,各步骤需适当延长时间。
银染基本显色液(5X)在低温环境下可能会出现少量沉淀,可在30-50℃水浴中溶解,并充分混匀后使用。至少后续稀释至1X后须确保完全溶解。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 固定:
电泳结束后,取凝胶放入约100ml固定液中,在摇床上室温摇动20分钟,摇动速度为60-70rpm。固定40分钟以上甚至过夜可以进一步降低背景。
固定液的配制:依次加入50ml乙醇、10ml乙酸和40ml Milli-Q级纯水或双蒸水,混匀后即成100ml固定液。
2. 30%乙醇洗涤:
弃固定液,加入100ml 30%乙醇,在摇床上室温摇动10分钟,摇动速度为60-70rpm。
30%乙醇的配制:70ml Milli-Q级纯水或双蒸水中加入30ml乙醇,混匀后即成100ml 30%乙醇。
3. 水洗涤:
弃30%乙醇,加入200ml Milli-Q级纯水或双蒸水,在摇床上室温摇动10分钟,摇动速度为60-70rpm。如果本步骤用水洗涤更长时间,对降低染色的背景略有帮助。
4. 增敏:
弃水,加入100ml银染增敏液(1X),在摇床上室温摇动2分钟,摇动速度为60-70rpm。
银染增敏液(1X)的配制:99ml Milli-Q级纯水或双蒸水中加入1ml银染增敏液(100X),混匀后即为银染增敏液(1X)。银染增敏液(1X)配制后需在2小时内使用。
5. 水洗涤(共2次):
弃原有溶液,加入200ml Milli-Q级纯水或双蒸水,在摇床上室温摇动1分钟,摇动速度为60-70rpm。
弃水,再加入200ml Milli-Q级纯水或双蒸水,在摇床上室温摇动1分钟,摇动速度为60-70rpm。
6. 银染:
弃水,加入100ml银溶液(1X),在摇床上室温摇动10分钟,摇动速度为60-70rpm。
银溶液(1X)的配制:99ml Milli-Q级纯水或双蒸水中加入1ml银溶液(100X),混匀后即为银溶液(1X)。银溶液(1X)配制后需在2小时内使用。
7. 水洗涤:
弃原有溶液,加入100ml Milli-Q级纯水或双蒸水,在摇床上室温摇动1-1.5分钟,摇动速度为60-70rpm。
注意:水洗涤的时间不能超过1.5分钟。
8. 显色:
弃水,加入100ml银染显色液,在摇床上室温摇动3-10分钟,直至出现比较理想的预期蛋白条带,摇动速度为60-70rpm。
银染显色液的配制:80ml Milli-Q级纯水或双蒸水中加入20ml银染基本显色液(5X),再加入0.05ml银染显色加速液(2000X),混匀后即为银染显色液。银染显色液配制后需在20分钟内使用。
9. 终止:
弃银染显色液,加入100ml银染终止液(1X),在摇床上室温摇动10分钟,摇动速度为60-70rpm。终止时有气体产生属正常现象,产生的气体为二氧化碳。
银染终止液(1X)的配制:95ml Milli-Q级纯水或双蒸水中加入5ml银染终止液(20X),混匀后即为银染终止液(1X)。银染终止液(1X)配制后宜当天使用。
10. 水洗涤:
弃银染终止液,加入100ml Milli-Q级纯水或双蒸水,在摇床上室温摇动2-5分钟,摇动速度为60-70rpm。
11. 保存:
可在Milli-Q级纯水或双蒸水中保存。或采用适当的方式制备成干胶。
常见问题:
1. 背景太深:
a. 显色时间过长。通常显色反应会在10分钟内结束,显色反应时间过长会导致背景很深。
b. 洗涤不充分。洗涤时间过短,或洗涤液加入的量不足,或者容器过于狭小导致摇动时溶液不易充分混合,或摇动速度过慢,导致混匀不充分。请按照说明书的建议确保各种溶液的用量和作用时间,摇床的推荐速度为60-70rpm。
c. 凝胶中原有的缓冲液等未在固定步骤中去除干净。一方面需确保固定的时间和固定液的用量,另一方面对于不是最常用的Bis-Tris缓冲的凝胶需要更长的固定时间以充分去除凝胶中的原有缓冲成分,以降低背景。
d. 水的纯度太低。需使用大于16 MΩ.cm的高纯度水。
2. 蛋白条带非常浅:
a. 蛋白的半胱氨酸(Cysteine)残基的含量特别低或几乎没有。半胱氨酸残基的存在对于银染非常重要,半胱氨酸残基的含量过低会导致检测灵敏度下降。
b. 银染后水洗涤时间过长。在银溶液染色时需严格控制水洗涤的时间,水洗涤的时间不能超过1.5分钟,否则会导致过多的银离子被洗去,导致检测灵敏度下降。
c. 上样量不足。本试剂盒检测BSA的灵敏度可以达到0.3ng,对于不同的蛋白检测灵敏度可能不同。对于一些蛋白可能需要大于1ng的蛋白量才能被检测到。
d. 固定步骤后的洗涤不够充分。导致少量乙酸残留,影响后续检测。确保30%乙醇洗涤和水洗涤的用量和时间,可以适当延长洗涤时间。
3. 凝胶上出现小点或或其它非蛋白的痕迹:
a. 凝胶没有充分被溶液浸没。请注意选择大小合适的容器,并加入足量的各种溶液,同时需保持适当的混匀速度确保凝胶可以被溶液浸没。
b. 用于银染的容器没有充分洗涤干净。容器需先用洗涤剂充分洗涤,随后用自来水充分冲洗,最后用高纯度水再洗涤数次。该容器最好能专用于银染,并注意避免各种可能的蛋白污染。为确保充分洗涤干净,对于耐硝酸的容器,例如玻璃容器,可以在上述洗涤剂及自来水洗涤后用50%硝酸洗涤,随后用高纯度水充分洗涤。
c. 指纹或其它压痕。请注意戴手套操作,切勿直接接触皮肤。操作时请注意尽量勿挤压、折叠或摩擦凝胶。
d. 有金属物质接触凝胶。金属物质例如金属镊子等接触凝胶会出现非特异性痕迹。
4. 在60-70 kD处出现一片模糊的蛋白染色背景:
皮肤上脱落的角蛋白(keratin)污染了蛋白样品。一方面需注意戴手套操作,另一方面需注意盛放蛋白样品的容器盖子尽量不要敞开,甚至在取放蛋白样品时在超净台内进行以避免可能的角蛋白污染。
5. 在凝胶的顶端处出现黄色背景:
a. 样品中DTT浓度很高。采用其它适当的还原试剂,或者在许可范围内适当减少DTT的用量。
b. 采用Tris-Glycine-SDS电泳体系。Tris-Glycine-SDS电泳体系中的Glycine会导致背景凝胶的顶端出现轻微的黄色背景。换用Tris-Tricine-SDS电泳体系则可显著消除此黄色背景。
6. 银在染色器皿中出现沉淀:
染色器皿中可能含有残余的洗涤剂或上次银染时的残余试剂。需确保把染色器皿洗涤干净。