上海细胞库
人源细胞系| 稳转细胞系| 基因敲除株| 基因点突变细胞株| 基因过表达细胞株| 重组细胞系| 猪的细胞系| 马细胞系| 兔的细胞系| 犬的细胞系| 山羊的细胞系| 鱼的细胞系| 猴的细胞系| 仓鼠的细胞系| 狗的细胞系| 牛的细胞| 大鼠细胞系| 小鼠细胞系| 其他细胞系|
| 规格 | 价格 | 库存 |
|---|---|---|
| 50-500次 | ¥ 988 | 200 |
| 200-2000次 | ¥ 2980 | 200 |
EdU细胞增殖检测试剂盒(DAB法)(EdU Cell Proliferation Kit with DAB),是一种基于DNA合成过程中胸腺嘧啶脱氧核苷(thymidine)类似物EdU(5-ethynyl-2' -deoxyuridine)的掺入,并通过随后的点击反应(Click reaction)使EdU被生物素(Biotin)所标记,然后加入的辣根过氧化物酶标记链霉亲和素(HRP-Streptavidin)与生物素结合,最后通过DAB显色,从而实现简单、快速、高灵敏地检测细胞增殖的试剂盒。
本试剂盒可以检测到细胞或组织样品中单个的增殖细胞,同时也可以对细胞或组织样品总体的细胞增殖情况进行定量检测。本试剂盒可以检测培养的细胞或组织样品,也可以检测组织切片,但均需提前进行EdU的掺入。
细胞增殖能力的检测是评估细胞活性、基因毒性和抗肿瘤药物效果等的基本方法。公认的最精确的检测细胞增殖的方法是直接检测细胞中DNA的合成。最初广泛使用的通过检测DNA合成来检测细胞增殖的方法是放射性标记核苷掺入法,如氚标记胸腺嘧啶脱氧核苷([3H]thymidine)掺入法。但该方法由于有放射性污染并且很难实现单细胞检测而受到很大的限制,随后逐渐被基于抗体检测的BrdU(bromo-deoxyuridine)法所替代。BrdU法步骤繁多,且需要使用BrdU抗体,影响因素较多,稳定性比较差。并且由于BrdU法需要使用抗体,有时会和其它目的蛋白基于抗体的检测相互产生干扰。EdU法基于EdU掺入和后续的点击反应,无需使用抗体、操作便捷、检测灵敏度高,是一种在BrdU法基础上升级换代的新方法,将会逐步取代BrdU法。
MTT法(C0009)、WST-1法(C0035、C0036)、CCK-8法(C0037、C0038、C0039、C0040、C0041、C0042、C0043、C0046)和CellTiter-Lumi™化学发光法(C0065、C0068)都是基于细胞活性的细胞增殖检测方法,能检测到细胞的总体增殖效果,但无法检测到单个的增殖细胞。这几种方法尽管都不是检测DNA合成的,但被广泛用于替代[3H]thymidine掺入法。CFDA SE法(C0051、C1031)基于细胞荧光示踪的原理能检测到单个的增殖细胞,但由于每增殖一次荧光减弱一半,在荧光显微镜下较难区分荧光减弱一半的细胞,检测灵敏度不是很高,通常仅适用于流式细胞仪检测。在进行科学研究时,上述这些基于细胞活性或CFDA SE的方法可以作为EdU法的补充性检测方法。
EdU(5-ethynyl-2' -deoxyuridine),中文名为5-乙炔基-2' -脱氧尿苷,是一种新型胸苷(胸腺嘧啶脱氧核苷,thymidine)类似物,EdU可以在DNA合成过程中替代胸苷掺入到新合成的DNA中。另一方面,EdU上的乙炔基能与生物素标记的叠氮化物(Biotin labeled azide)通过一价铜离子的催化发生共价反应,形成稳定的三唑环,该反应非常迅速,被称作点击反应(Click reaction),其反应原理参见图1。通过点击反应,新合成的DNA会被相应的生物素探针所标记,从而可以使用适当的检测设备检测到增殖的细胞。
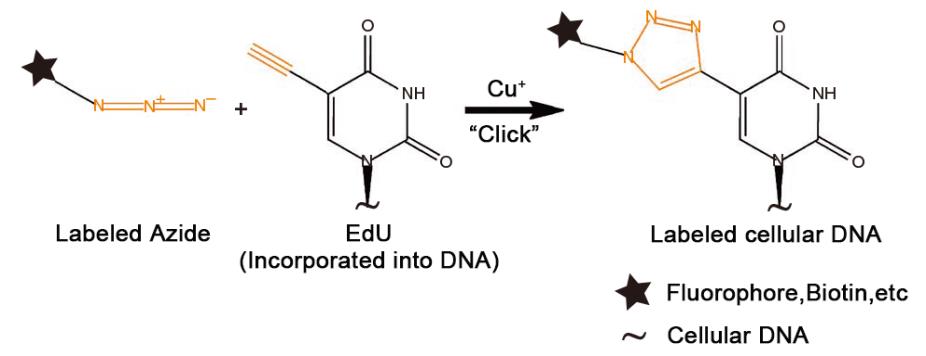
图1. EdU检测法中的点击反应(Click reaction)原理图。生物素或荧光探针等标记的叠氮化物(Labeled Azide)与掺入到细胞DNA中的EdU,在铜离子的催化发生共价反应,形成稳定的三唑环,最终使细胞DNA标记上生物素等探针。
本试剂盒反应简单、检测灵敏度高。本试剂盒基于简单高效的点击反应,无需DNA变性,只需少量的小分子叠氮化物探针即可非常有效地标记出掺入的EdU,并且可以检测到单个细胞的增殖情况。
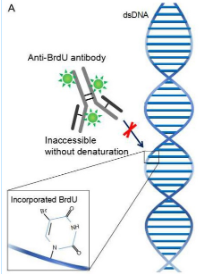
本试剂盒使用便捷、兼容性好。本试剂盒只需常用的多聚甲醛固定和Triton X-100穿透,就可以使叠氮化物探针有效进入细胞并发生点击反应,不会影响细胞形态,不会影响基于抗体的免疫荧光和免疫组化检测,也不会影响DNA的荧光染色(如PI染色检测细胞周期、DAPI或Hoechst染料检测细胞核)。而BrdU法为了使大分子的BrdU抗体进入细胞并与DNA上的BrdU结合,需要对双链DNA进行变性处理(如酸变性、热变性或者DNase消化等),这种变性可能会影响细胞形态,影响后续的免疫荧光和免疫组化检测、DNA的荧光染色等。BrdU法和 EdU法检测原理的比较参见图2。
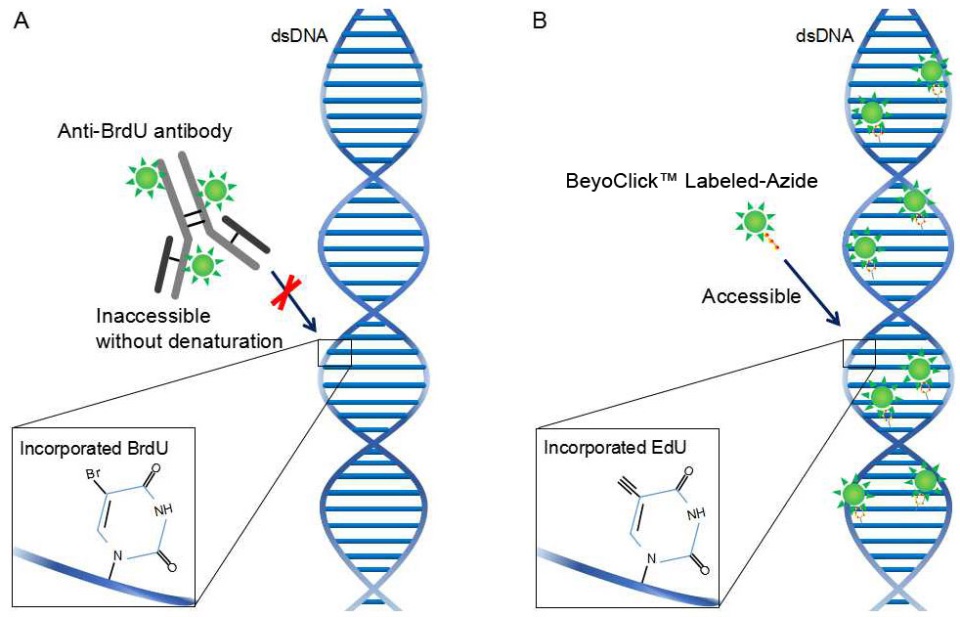
图2. BrdU法和 EdU法检测原理的比较。A. BrdU法需使用大分子的BrdU抗体,由于空间位阻,双链DNA须变性后才能使BrdU抗体与BrdU结合。B. EdU法使用小分子标记的叠氮化物(Azide),无需DNA变性,操作更便捷,兼容性好,检测结果更加稳定可靠。
本试剂盒检测快速。相对于BrdU法,本试剂盒采用 EdU法检测新合成的DNA,所需时间显著缩短。
经本试剂盒处理后,增殖的细胞呈棕色,可以用普通光学显微镜进行观察。HeLa细胞用本试剂盒检测细胞增殖的效果参见图3。
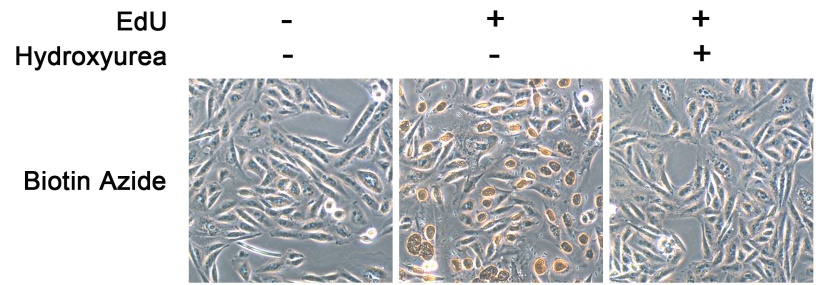
图3. HeLa细胞用本试剂盒检测细胞增殖的效果图。无EdU组观察不到棕色染色(最左侧一列);EdU (10μM)孵育2小时组有明显的棕色染色(中间一列);而用10mM的DNA合成抑制剂羟基脲(Hydroxyurea)提前预处理0.5小时后,棕色染色显著减弱,说明DNA合成被抑制后,EdU的掺入被显著抑制(最右侧一列)。
各种细胞增殖和细胞毒性检测试剂盒的比较和选择,请参考 http://www.beyotime.com/cell-proliferation.htm。
本试剂盒小包装C0085S如果用于培养的细胞(6孔板)的检测,可以检测50个样品,每个样品的反应体系为500μl的Click反应液;如果用于96孔板检测,可以检测500个样品,每个样品的检测体系为50μl的Click反应液;如果用于12孔、24孔、48孔或384孔板样品的检测,分别可以检测125、250、350和1250个样品,每个样品推荐的Click反应液用量为200μl、100μl、70μl和20μl。小包装如果用于冰冻或石蜡切片的检测,可以检测125-250个样品,每个样品的反应体系为100-200μl的Click反应液。大包装C0085L可检测样品的数量为小包装C0085S的4倍。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C0085S-1 | EdU (10mM) | 200μl |
| C0085S-2 | Biotin Azide | 55μl |
| C0085S-3 | Click Reaction Buffer | 30ml |
| C0085S-4 | CuSO4 | 0.6ml |
| C0085S-5 | Click Additive | 2管 |
| C0085S-6 | Streptavidin-HRP | 220μl |
| C0085S-7 | Streptavidin-HRP稀释液 | 10ml |
| C0085S-8 | DAB显色液A | 10ml |
| C0085S-9 | DAB显色液B | 10ml |
| — | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。Biotin Azide、DAB显色液A和DAB显色液B须避光保存。
注意事项:
Click Additive配制成溶液后请注意适当分装。如果溶解后有白色物质析出,请上下颠倒多次,待全部溶解后使用。如果该溶液颜色变成棕色,说明该组分的有效成分已失效,请弃用。
DAB对人体有害,操作时请小心,并注意有效防护以避免直接接触人体或吸入体内。
f. 去离子水或超纯水。
g. 根据实验要求:18×18mm盖玻片,6孔板或其它多孔板。
2. 检测体系的准备
a. 如下以6孔板或常规切片检测体系为例,如果使用12孔板、96孔板或384孔板等孔板,检测体系可以相应按比例缩小。
b. 如果检测的是悬浮细胞,请按常规的悬浮细胞的操作方式进行。例如和贴壁细胞相比,相关步骤需要增加离心步骤等。
3. 培养细胞的EdU标记及固定、洗涤和通透
a. 在6孔板中(如有必要可以加入盖玻片)培养适当数量的细胞。细胞培养过夜并且恢复到正常状态后,进行所需的药物处理或者其它刺激处理等。
b. 配制2X的EdU工作液:由于EdU工作液是与培养液等体积加入到孔板中,所以需要配制成2X的工作液。推荐的EdU终浓度为10μM (1X),用细胞培养液1:500稀释EdU (10mM)即可得到2X的EdU工作液(20μM)。
注意:对于A549、HeLa和NIH/3T3等贴壁细胞,推荐EdU的使用终浓度为10μM。但细胞类型、培养液种类、细胞密度、细胞增殖速度等多方面的因素会影响EdU掺入到细胞中的量,因此初次使用时建议对EdU的使用浓度进行一定的摸索。如果之前使用过BrdU进行实验,则可以参考BrdU的终浓度作为EdU的终浓度。
c. 将37℃预热的2X的EdU工作液(20μM),等体积加入6孔板中,使6孔板中的EdU终浓度变为1X。例如设计终浓度为10μM,原先6孔板中的培养基为1ml,则将1ml 2X的EdU工作液(20μM)加入到孔板中。如果培养基体积过大,可以先吸除适量的培养液,再加入等体积的2X的EdU工作液;或者可以减少工作液的体积并增加EdU的浓度,使最终培养液中的EdU浓度为10μM,例如2ml培养液中加入220微升0.1mM EdU。更换所有的培养液可能会对细胞的增殖有影响,因此不建议替换所有的培养液。
d. 继续孵育细胞2小时。该孵育时间的长短取决于细胞生长速率,通常宜继续孵育细胞周期10%左右的时间。对于常见的哺乳动物细胞如HeLa、3T3、HEK293等,细胞周期大约在18-25小时,孵育时间宜在2小时左右。人胚胎细胞的细胞周期约30分钟,推荐的孵育时间为5分钟;酵母细胞的细胞周期约3小时,推荐的孵育时间为20分钟,增殖的神经细胞其细胞周期约5天,推荐的孵育时间为1天。孵育时间小于45分钟时,建议提高EdU的浓度;孵育时间大于20小时时,建议适当降低EdU的浓度。
e. EdU标记细胞完成后,去除培养液,并加入1ml固定液(可以使用免疫染色固定液P0098,或4%的多聚甲醛P0099),室温固定15分钟。
f. 去除固定液,每孔用1ml洗涤液洗涤细胞3次,每次3-5分钟。
g. 去除洗涤液,每孔用1ml通透液(可以使用免疫染色强力通透液P0097,免疫染色洗涤液P0106,或含0.3% Triton X-100的PBS),室温孵育10-15分钟。
h. 去除通透液,每孔用1ml洗涤液洗涤细胞1-2次,每次3-5分钟。
i. 再用内源性过氧化物酶封闭液室温孵育20分钟,以灭活内源的过氧化物酶。随后用洗涤液洗涤3次,每次2分钟。
j. 转步骤5。
4. 动物体内EdU的标记及切片样品的处理
EdU可以通过注射或进食等适当方式进行动物的体内标记。如下以小鼠为例,其它动物体内EdU的标记请参考相关文献。
a. 对于小鼠,可以按照10-200mg/kg的用量,把EdU用PBS配制成一定浓度,腹腔注射、特定组织或器官局部注射或者加入饮用水中。具体用量跟所用动物的种类、体重和使用方式有关,可以参考相关文献,因此初次使用时建议对EdU的使用浓度进行一定的摸索,或者直接使用50mg/kg的浓度进行测试。如果之前使用过BrdU进行实验,则可以参考BrdU的终浓度作为EdU的终浓度。EdU可以单独购买ST067。
b. 4小时后或根据特定实验确定的适当时间后,快速处死小鼠,取出所需的组织,按照常规步骤制作冰冻切片或石蜡切片。EdU标记的时间也可以参考相关文献自行调整。
c. 对于冰冻切片:
(a) 加入适量固定液(可以使用免疫染色固定液P0098,或4%的多聚甲醛P0099),室温固定15分钟。
(b) 去除固定液,用适量洗涤液洗涤3次,每次3-5分钟。
(c) 去除洗涤液,用适量通透液(可以使用免疫染色强力通透液P0097,免疫染色洗涤液P0106,或含0.3% Triton X-100的PBS),室温孵育10-15分钟。
(d) 去除通透液,用适量洗涤液洗涤1-2次,每次3-5分钟。
(e) 抗原修复(选做):如果同时需要进行目的蛋白的免疫荧光染色,并有必要进行抗原修复,可以使用适当的抗原修复液,例如P0090冰冻切片快速抗原修复液(5X),或者自行配制的适当的抗原修复液进行抗原修复处理。
(f) 用内源性过氧化物酶封闭液室温孵育20分钟,以灭活切片内源的过氧化物酶。随后用洗涤液洗涤3次,每次2分钟。
(g) 转步骤5。
d. 对于石蜡切片:
(a) 脱蜡:二甲苯中脱蜡5-10分钟。换用新鲜的二甲苯,再脱蜡5-10分钟。无水乙醇5分钟,换新的无水乙醇3分钟。95%乙醇3分钟。85%乙醇3分钟。75%乙醇3分钟。50%乙醇3分钟。PBS 5分钟。
(b) 抗原修复(选做):如果同时需要进行目的蛋白的免疫组化染色,可以使用适当的抗原修复液,例如P0081柠檬酸钠抗原修复液(50X)、P0083改进型柠檬酸钠抗原修复液(50X)、P0085 EDTA抗原修复液(50X)、P0086柠檬酸钠-EDTA抗原修复液(40X)、P0088通用型强力抗原修复液(10X)、P0092漂片抗原修复液(10X),或者自行配制适当的抗原修复液进行抗原修复处理。
特别注意:如果使用蛋白酶K或胰酶进行抗原修复,必须反复洗涤干净,否则残留的酶会严重干扰后续标记反应。
(c) 用内源性过氧化物酶封闭液室温孵育20分钟,以灭活切片内源的过氧化物酶。随后用洗涤液洗涤3次,每次2分钟。
(d) 转步骤5。
5. EdU检测
注意:本步骤六孔板中每孔的反应体系为500μl的反应混合物。对于12、24、48、96和384孔板,每孔的反应的体系分别为200μl、100μl、70μl、50μl和20μl的反应混合物。对于较小的孔,单位培养面积的液体用量已经适当增加,以有效避免液体蒸发可能带来的负面影响。对于切片,可以根据切片大小,每个切片使用100-200μl的反应混合物。如下以六孔板中的细胞样品为例说明具体的操作方法,对于其它孔板或切片,仅每步溶液的用量按比例调整即可,其余方法相同。
a. 配制Click Additive Solution:对于C0085S,用1.3ml去离子水溶解一管Click Additive,混匀至全部溶解,即为Click Additive Solution;对于C0085L,加入10.4ml去离子水溶解试剂盒中提供的一瓶Click Additive,混匀至全部溶解,即为Click Additive Solution。配制后可以适当分装,并-20℃保存。
b. 参考下表配制Click反应液。注意:请严格按照下表中组分顺序和体积配制Click反应液,否则点击反应可能无法有效进行;同时,Click反应液须在配制后15分钟内使用。
| 组分 | 6孔板样品数 | ||||||
| 1 | 2 | 4 | 5 | 10 | 25 | 50 | |
| Click Reaction Buffer | 440μl | 880μl | 1.8ml | 2.2ml | 4.4ml | 11ml | 22ml |
| CuSO4 | 10μl | 20μl | 40μl | 50μl | 100μl | 250μl | 500μl |
| Biotin Azide | 1μl | 2μl | 4μl | 5μl | 10μl | 25μl | 50μl |
| Click Additive Solution | 50μl | 100μl | 200μl | 250μl | 500μl | 1.25ml | 2.5ml |
| 总体积 | 500μl | 1ml | 2ml | 2.5ml | 5ml | 12.5ml | 25ml |
c. 去除上一步骤中的洗涤液。
d. 每孔加入0.5ml Click反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品。
e. 室温避光孵育30分钟。孵育时需注意在多孔板的空隙中加水,或者对于切片宜使用湿盒(例如载玻片染色盒FSR958)来保持湿润,以尽量减少反应液的蒸发。
f. 吸除Click反应液,用洗涤液洗涤3次,每次3-5分钟。
6. Streptavidin-HRP工作液和DAB显色液的配制:
a. Streptavidin-HRP工作液的配制:
参考下表配制适量的Streptavidin-HRP工作液,须充分混匀。注意:配制好的Streptavidin-HRP工作液必须一次使用完毕,不宜冻存。
| 组分 | 6孔板样品数 | ||||||
| 1 | 2 | 4 | 5 | 10 | 25 | 50 | |
| Streptavidin-HRP | 4μl | 8μl | 16μl | 20μl | 40μl | 100μl | 200μl |
| Streptavidin-HRP稀释液 | 196μl | 392μl | 784μl | 980μl | 1.96ml | 4.9ml | 9.8ml |
| Streptavidin-HRP工作液 | 200μl | 400μl | 800μl | 1ml | 2ml | 5ml | 10ml |
b. DAB显色液的配制:
按照每个样品使用0.2-0.4ml显色液的比例配制适量DAB显色液。等体积混合适量DAB显色液A和DAB显色液B,充分混匀后即为DAB显色液。注意:配制好的DAB显色液必须一次使用完毕,不宜冻存。
7. 样品的显色:
a. 在样品上加200μl Streptavidin-HRP工作液,室温孵育30分钟。
注意:Streptavidin-HRP工作液的用量以完全覆盖样品为准。孵育时需注意在多孔板的空隙中加水,或者对于切片宜使用湿盒(例如载玻片染色盒FSR958)来保持湿润,以尽量减少Streptavidin-HRP工作液的蒸发。
b. 用洗涤液洗涤3次,每次2分钟。
c. 滴加0.2-0.4ml DAB显色液,室温孵育5-30分钟。
注:如果显色很强可以短于5分钟即停止显色,如果显色很弱,可以适当延长显色时间,甚至显色过夜。
d. 用洗涤液洗涤3次,即可终止显色反应。如有必要可以使用适当的染色液进行复染,如伊红染色液C0109、甲基绿染色液C0115、苏木素染色液C0107、DAPI染色液C1005等。普通光学显微镜或荧光显微镜下观察并拍照记录。