上海细胞库
人源细胞系| 稳转细胞系| 基因敲除株| 基因点突变细胞株| 基因过表达细胞株| 重组细胞系| 猪的细胞系| 马细胞系| 兔的细胞系| 犬的细胞系| 山羊的细胞系| 鱼的细胞系| 猴的细胞系| 仓鼠的细胞系| 狗的细胞系| 牛的细胞| 大鼠细胞系| 小鼠细胞系| 其他细胞系|

| 规格 | 价格 | 库存 |
|---|---|---|
| 250次 | ¥ 1580 | 200 |
生产的支原体PCR检测试剂盒(Mycoplasma PCR Detection Kit),是一种通过巢式PCR法(Nested PCR)检测培养细胞等生物材料中是否存在支原体污染的检测试剂盒。
支原体(Mycoplasma)是最小、最简单的原核生物。支原体有如下特征:支原体无细胞壁结构,所以针对细胞壁的许多常见的抗生素,如青霉素或β-内酰胺类抗生素对支原体无效;支原体大小介于细菌和病毒之间,约为0.2-0.8μm,所以部分支原体可通过0.22μm滤器,常规的过滤对支原体无效;很多支原体由于自身的生物合成能力有限而依靠宿主提供营养,所以通常吸附或散落在细胞表面和细胞之间。支原体的这些特征使细胞培养过程中存在支原体污染的风险,细胞的支原体污染已经成为一个世界性的普遍问题。
支原体污染可能会严重影响细胞的状态,使细胞的基因表达、代谢特征发生变化,导致细胞生长减缓、分化和死亡异常,严重影响细胞功能。这些影响因素会严重影响实验结果的可靠性、可重复性和一致性,因此支原体污染的检测非常重要。
细胞培养过程中的细菌、酵母或霉菌污染在光学显微镜下可见,但支原体污染在光学显微镜下通常不可见,必须通过特定的检测方法进行检测。检测支原体污染的常用方法有支原体分离培养、ELISA、发光法等特殊的生化检测以及DNA荧光染色检测等。上述检测方法中,大多操作步骤相对比较烦琐、灵敏性不高、不能区分支原体种类、需要特殊仪器或所需时间较长。而PCR法操作相对比较简单便捷,PCR扩增后通过电泳分析即可确定是否有支原体污染,并可根据扩增片段的大小大致预测至少11种所污染的支原体种属。如果有必要,也可以对PCR产物进行常规测序以确定具体的支原体种属。
本支原体PCR检测试剂盒是利用两对引物通过巢式PCR法特异性扩增支原体基因组DNA片段,从而实现对支原体的高灵敏度特异性检测的。原核生物的rRNA碱基序列非常保守,而rRNA操纵子上编码rRNA的DNA间隔区(space region)在各种生物种间的碱基序列差别很大,如16S和23S之间的间隔区。这个间隔区的DNA序列及长度在支原体各个种属间既有非常保守的部分,也有较大差异的部分。在编码16S和23S的保守区DNA上设计一对F1/R1引物,用于扩增16S和23S之间的间隔区,这就是巢式PCR的第一轮PCR (1st PCR),用于初步鉴定是否有支原体污染;然后在编码16S和23S rRNA的DNA间隔区的保守区上设计一条F2引物,在编码23S rRNA的DNA上设计一条R2引物进行巢式PCR的第二轮PCR (2nd PCR)。通过巢式PCR可以大大提高检测的特异性和灵敏度。本产品的检测原理请参考图1。
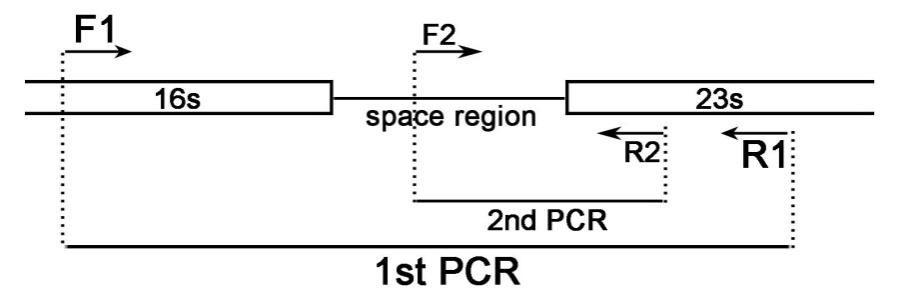
图1. 支原体PCR检测试剂盒的检测原理图。
本试剂盒可快速、有效、高灵敏度地检测支原体污染。
本试剂盒提供了阳性对照Control template,便于确定PCR检测是否能正常工作,及样品中是否存在抑制PCR反应的物质。
如果发现有支原体污染,建议更换无污染的细胞进行培养。如果有必要预防或去除支原体,可以使用专用的支原体预防或去除试剂(C0288、C0290、C0292、C0293)。
如果用于20μl的PCR反应体系,本试剂盒共可以进行250次检测。如果用于50μl的PCR反应体系,本试剂盒共可以进行100次检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C0301S-1 | 1st PCR Primer Mix (50X) | 100μl |
| C0301S-2 | 2nd PCR Primer Mix (50X) | 100μl |
| C0301S-3 | Control template | 100μl |
| - | 说明书 | 1份 |
保存条件:
-20℃保存。
注意事项:
由于PCR反应非常灵敏,可以扩增目的基因序列超过1000万倍,在使用Taq酶时请注意避免微量待扩增DNA的污染,并尽量考虑设置不加模板的空白对照以确认是否有待扩增DNA的污染。
一般情况,1st PCR可以初步鉴定是否有支原体污染,但建议进行2nd PCR以进一步确认。
本试剂盒不能检测出人肺炎支原体(Mycoplasma pneumoniae)。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 实验前的准备工作:
a. 需要用户自己准备的器材
(a) PCR扩增仪。
(b) 琼脂糖凝胶电泳装置。
(c) 微量离心机。
(d) 无菌PCR管、离心管、枪头及移液枪。
b. 试剂和检测样品准备
(a)双蒸水或超纯水。
(b)2X PCR Master Mix (D7228)、Easy-Load™ PCR Master Mix (2X) (D7251/D7255/D7259)或者其它Taq酶及PCR所需的dNTP等。
(c)琼脂糖凝胶、电泳缓冲液、DNA分子量标准、电泳染料。
(d)样品:用于检测支原体污染的样品是细胞接种后培养了3-6天的培养上清液,或者是培养液、血清;如果使用细胞悬液做样品,则需要提取DNA后再进行PCR。加入量一般为反应体系1/10的量或更少。
2. 1st PCR反应:
a. 融解并混匀PCR反应所需的各种溶液。将2X PCR Master Mix,例如Easy-Load™ PCR Master Mix (Green, 2X)置于冰浴上或冰盒内。参考下表在冰浴上设置PCR反应:
| 试剂 | 最终浓度 | 体积 | 体积 |
| 双蒸水或超纯水 | - | 7.6-9.2μl | 19-23μl |
| 检测样品(DNA)或Control template | 0.2pg/μl -20ng/μl | 0.4-2μl | 1-5μ |
| 1st PCR Primer Mix (50X) | 1X | 0.4μl | 1μl |
| Easy-Load™ PCR Master Mix (Green, 2X) | 1X | 10μl | 25μl |
| 总体积 | - | 20μl | 50μl |
注:Control template的推荐用量为1μl。
b. PCR反应参数的设置可以参考如下示例:
STEP1 (起始变性): 94ºC 30sec
STEP2 (变性): 94ºC 30sec
STEP3 (退火): 55ºC 2min
STEP4 (延伸): 72ºC 1min
STEP5 (循环): Go To STEP2 for 30-35 cycles
STEP6 (最终延伸): 72ºC 5min
STEP7 (临时保存): 4ºC forever
3. 2nd PCR反应::
a. 参考下表在冰浴上设置PCR反应:
| 试剂 | 最终浓度 | 体积 | 体积 |
| 双蒸水或超纯水 | - | 9.4μl | 23.5μl |
| 1st PCR产物 | 0.2pg/μl -20ng/μl | 0.2μl | 0.5μl |
| 2nd PCR Primer Mix (50X) | 1X | 0.4μl | 1μl |
| Easy-Load™ PCR Master Mix (Green, 2X) | 1X | 10μl | 25μl |
| 总体积 | - | 20μl | 50μl |
b. PCR反应参数的设置可以参考如下示例:
STEP1 (起始变性): 94ºC 30sec
STEP2 (变性): 94ºC 30sec
STEP3 (退火): 55ºC 2min
STEP4 (延伸): 72ºC 1min
STEP5 (循环): Go To STEP2 for 30 cycles
STEP6 (最终延伸): 72ºC 5min
STEP7 (临时保存): 4ºC forever
4. 扩增产物的电泳分析:
a. 反应结束后,取1st PCR及2nd PCR的反应产物各10μl,进行电泳确认扩增有无片段及片段大小。琼脂糖凝胶电泳结果示意图请参考图2。如果实验目的只是确定是否有支原体污染,1-2%的琼脂糖凝胶电泳均可;如果需要确定片段大小并据此大致推测污染支原体的种类,优先推荐使用2%的琼脂糖凝胶电泳。
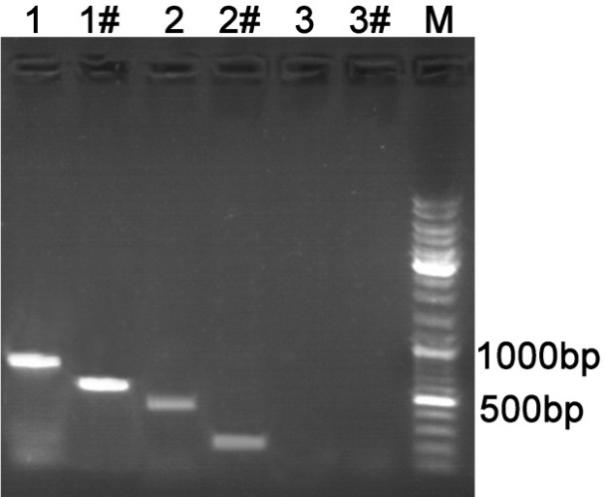
图2. 使用本支原体PCR检测试剂盒进行PCR检测时扩增产物的琼脂糖凝胶电泳示意图。1、2、3是1st PCR产物;1#、2#、3#是相应的2nd PCR产物。各泳道的模板分别是:1和1#,Control template;2和2#,支原体污染的细胞上清;3和3#,超纯水。M为DNA marker。
b. 以不同种属的支原体为模板,1st PCR及2nd PCR的反应产物的条带大小不同,具体扩增片段大小可参考下表。
本试剂盒确定可以扩增的支原体种类及1st PCR和2nd PCR扩增产物长度参考表:
| 种属 | GenBank编号 | 1st PCR (bp) | 2nd PCR (bp) |
| Mycoplasma arginini | JN935883 | 370 | 145 |
| Mycoplasma arthritidis | AY973560 | 408 | 157 |
| Mycoplasma capricolum | AY800346 | 415 | 221 |
| Mycoplasma fermentans | AY816338 | 492 | 195 |
| Mycoplasma hominis | AY738737 | 370 | 148 |
| Mycoplasma hyopneumoniae | JN935889 | 682 | 238 |
| Mycoplasma hyorhinis | AY973572 | 452 | 211 |
| Mycoplasma neurolyticum | AY796063 | 502 | 196 |
| Mycoplasma orale | AY737010 | 424 | 179 |
| Mycoplasma pulmonis | JN935865 | 477 | 190 |
| Mycoplasma salivarium | AY786574 | 403 | 151 |
| Ureaplasma urealyticum | AY741673 | 482 | 154 |
注:本试剂盒主要用于检测是否有支原体污染,但也可以通过1st PCR和2nd PCR扩增产物长度大致预测所污染的支原体种属。如果有必要,也可以对PCR产物进行常规测序以确定具体的支原体种属。
5. 关于阳性对照反应:
a. 一方面阳性对照Control template可以单独使用,以确定PCR反应体系是否能正常工作。另一方面,阳性对照Control template也可以添加到样品中,以确定样品中是否含有抑制PCR反应的物质。Control template是人工合成的DNA片段,使用Control template时,1st PCR的反应产物是810bp,2nd PCR的反应产物是590bp。
b. 如果阳性对照Control template单独使用时没有获得扩增片段,提示PCR检测体系存在问题,需要考虑更换PCR反应相关试剂。
c. 如果阳性对照Control template单独使用时获得了预期的扩增片段,而阳性对照Control template添加到样品一起进行PCR扩增反应时没有获得任何PCR扩增产物,提示PCR体系工作正常,但检测样品中存在抑制PCR反应的物质。此时建议将检测样品进行DNA抽提,再用提取的DNA作为模板进行扩增。也可以尝试将样品用超纯水或PBS适当稀释后再进行测试,此时如果样品中支原体的污染程度比较高,基本上不会影响检测,但如果样品中支原体的污染程度比较低,很可能会导致检测灵敏度显著下降。
d. 如果阳性对照Control template单独使用时获得了预期的扩增片段,而阳性对照Control template添加到样品一起进行PCR扩增反应时可能仅获得支原体的PCR扩增产物或仅获得阳性对照Control template的扩增产物,也可能同时获得支原体和阳性对照Control template的扩增产物。其中一种模板量比较多时,通常更容易扩增获得哪种模板的PCR扩增产物。其中一种模板特别多时,另外一种模板可能检测不到明显的扩增。