上海细胞库
人源细胞系| 稳转细胞系| 基因敲除株| 基因点突变细胞株| 基因过表达细胞株| 重组细胞系| 猪的细胞系| 马细胞系| 兔的细胞系| 犬的细胞系| 山羊的细胞系| 鱼的细胞系| 猴的细胞系| 仓鼠的细胞系| 狗的细胞系| 牛的细胞| 大鼠细胞系| 小鼠细胞系| 其他细胞系|

| 规格 | 价格 | 库存 |
|---|---|---|
| 100次 | ¥ 316 | 200 |
乳酸脱氢酶细胞毒性检测试剂盒(LDH Cytotoxicity Assay Kit),也称乳酸脱氢酶检测试剂盒(LDH Assay Kit)或乳酸脱氢酶释放检测试剂盒(LDH Release Assay Kit),是一种基于diaphorase催化的INT显色反应,通过比色法检测细胞毒性时释放的乳酸 脱氢酶活性或检测其它样品中的乳酸脱氢酶活性的试剂盒。
本试剂盒可以用于常规的乳酸脱氢酶活性的检测,更常用于以LDH释放为指标的细胞毒性检测。同时,基于细胞总乳酸脱氢酶活性的检测,本试剂盒也可以用于检测细胞增殖和细胞毒性检测。
细胞凋亡或坏死而造成的细胞膜结构的破坏会导致细胞浆内的酶释放到培养液里,其中包括酶活性较为稳定的乳酸脱氢酶(lactate dehydrogenase, LDH)。通过检测从质膜破裂的细胞中释放到培养液中的LDH的活性,就可以实现对细胞毒性的定量分析。LDH释放被看做细胞膜完整性的重要指标,并被广泛用于细胞毒性检测。LDH释放被认为是以前使用放射性的51Cr标记细胞,随后通过51Cr释放进行 细胞膜完整性检测的安全有效的替代方法。
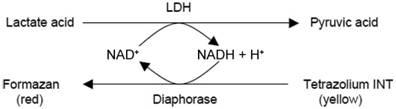
本试剂盒的基本原理是,在乳酸脱氢酶的作用下,NAD+被还原生成NADH,NADH和INT (2-p-iodophenyl-3-
nitrophenyl tetrazolium chloride)被硫辛酰胺脱氢酶(diaphorase)催化反应生成NAD+和强生色物甲臜(formazan),在490nm波长下产生吸收峰,从而可以通过比色来定量乳酸脱氢酶的活性。吸光度与乳酸脱氢酶活性成线性正相关。该酶联反应原理的示意图如下:
可检测细胞培养液、细胞裂解液等样品中乳酸脱氢酶的活性。一个试剂盒可进行100次检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C0016-1 | LDH释放试剂 | 1.5ml |
| C0016-2 | 乳酸溶液 | 2ml |
| C0016-3 | 酶溶液 | 1ml×2 |
| C0016-4 | INT溶液(10X) | 0.2ml |
| C0016-5 | INT稀释液 | 2ml |
| — | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。C0016-3需注意避免反复冻融。C0016-4需避光保存。试剂盒解冻后可以短期4℃存放,2-3天内有效。
注意事项:
冷冻会使样品中部分乳酸脱氢酶失活,4℃可放置2-3天。建议样品准备好后尽量当天完成测定。
如果检测细胞培养液中的乳酸脱氢酶,由于血清含有乳酸脱氢酶,建议血清的使用浓度不要超过1%,并最好使用热灭活血清。如果一定需要使用10%血清,在检 测时一定要设置没有细胞,但加入了相同体积培养液的对照孔,以用于消除背景。
细胞过度生长、密度过高、离心速度过大、培养箱内外温差过大,都会造成细胞释放乳酸脱氢酶增加。
如果希望进行乳酸脱氢酶活性的绝对定量,用户需自备乳酸脱氢酶标准品。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.样品的准备:
方法一:LDH释放检测
a.根据细胞的大小和生长速度将适量细胞接种到96孔细胞培养板中,使待检测时细胞密度不超过80-90%满。
b.吸去培养液,用PBS液洗涤一次。换新鲜培养液(推荐使用含1%血清的低血清培养液或适当的无血清培养液),将各培养孔分成如下几组:包括无细胞的培养液孔(背景空白对照孔),未经药物处理的对照细胞孔(样品对照孔),未经药物处理的用于后续裂解的细胞孔(样品最大酶活性对照孔),以及药物处理的细胞孔(药物处理样品孔),并做好标记。按照实验需要给予适当药物处理如加入0-10μl左右特定的药物刺激,可设置不同浓度,不同处理时间,对照孔中需加入适当的药物溶剂对照),继续按常规培养。到预定的检测时间点前1小时,从细胞培养箱里取出细胞培养板,在“样品最大酶活性对照孔”中加入试剂盒提供的LDH释放试剂,加入量为原有培养液体积的10%。加入LDH释放试剂后,反复吹打数次混匀,然后继续在细胞培养箱中孵育。
c.到达预定时间后,将细胞培养板用多孔板离心机400g离心5min。分别取各孔的上清液120μl,加入到一新的96孔板相应孔中,随即进行样品测定。
方法二:细胞内总LDH的检测
a.细胞毒性检测:根据细胞的大小和生长速度将适量细胞接种到96孔细胞培养孔板中,使待检测时细胞密度不超过80-90%满。加入不同药物进行处理,并设置适当对照。药物刺激完毕后,将细胞培养板用多孔板离心机400g离心5min。尽量吸除上清,加入150μl用PBS稀释了10倍的试剂盒提供的LDH释放试剂(10体积PBS中加入1体积LDH释放试剂并混匀,适当摇晃培养板混匀,然后继续在细胞培养箱中孵育1小时。随后将细胞培养板用多孔板离心机400g离心5min。分别取各孔的上清液120μl,加入到一新的96孔板相应孔中,随即进行样品测定。
b.细胞增殖检测:根据细胞的大小和生长速度将适量细胞接种到96孔细胞培养孔板中,使促进细胞增殖的药物刺激后细胞不超过80-90%满为宜。使用不同的药物刺激细胞,并设置适当对照。药物刺激完毕后,将细胞培养板用多孔板离心机400g离心5min。尽量吸除上清,加入150μl用PBS稀释了10倍的试剂盒提供的LDH释放试剂(10体积PBS中加入1体积LDH释放试剂并混匀),适当摇晃混匀胞,然后继续在细培养箱中孵育1小时。随后将细胞培养板用多孔板离心机400g离心5min。分别取各孔上清液120μl,加入到一新的96孔板相应孔中,随即进行样品测定。
注:LDH释放检测更加常用一些,细胞内总LDH检测通常可以使用MTT、WST-1或CCK-8等方法替代。
2. 试剂盒的准备工作:
a.INT溶液(1X)的配制:根据所需的INT溶液(1X)的量,取适量INT溶液(10X)用INT稀释液稀释至1X。例如,取20μl INT溶液(10X),加入180μl INT 稀释液,混匀后即配制为200μl INT溶液(1X)。INT溶液(1X)宜现配现用,配制后4℃保存可于当天使用,不宜配制后冻存。
b.LDH检测工作液的配制: 根据待测定的样品数(含对照),参考下表在临检测前新鲜配制适量的检测工作液。
注意:LDH检测工作液必须现配现用,配制和使用过程中均要注意适当避光。
| 检测次数 | 1次 | 10次 | 20次 | 50次 |
| 乳酸溶液 | 20μl | 200μl | 400μl | 1ml |
| INT溶液(1X) | 20μl | 200μl | 400μl | 1ml |
| 酶溶液 | 20μl | 200μl | 400μl | 1ml |
| 总体积 | 60μl | 600μl | 1.2 ml | 3ml |
c.(选做)如果希望进行LDH酶活性的绝对定量,需自备LDH标准品,并新鲜配制不同浓度LDH标准品,如10mU/ml、5mU/ml、2.5mU/ml、1.25mU/ml、 0.65mU/ml、0 mU/ml。
3. 样品测定:
a.各孔分别加入60μl LDH检测工作液。
b.混匀,室温(约25℃) 避光孵育30min(可用铝箔包裹后置于水平摇床或侧摆摇床上缓慢摇动)。然后在490nm处测定吸光度。使用600nm或大于600nm的任一 波长作为参考波长进行双波长测定。
c.计算(测得的各组吸光度均应减去背景空白对照孔吸光度)
d.细胞毒性或死亡率(%)=(处理样品吸光度-样品对照孔吸光度) / (细胞最大酶活性的吸光度-样品对照孔吸光度)×100
e.可绘制细胞毒性曲线:纵座标为实际吸光度,横坐标为药物浓度;据此可计算该药物作用特定时间的半致死剂量LD50。
附录1:
可同时测定一已知浓度的LDH酶标准品对应的吸光度值,参考以下公式粗略计算出样品中LDH酶活力:
待测样品中LDH活力单位(mU/ml)=
(样品孔吸光度-背景空白对照孔吸光度) / (标准管吸光度-标准空白管吸光度)×标准品浓度(mU/ml);
根据计算结果可以比较不同样品处理组间有无统计学差异等。
附录2:
若需准确计算出LDH酶活性的绝对活性,可通过一系列LDH标准品及相应测得的吸光度值绘制标准曲线,通过标准曲线相应公式计算出样品中LDH的酶活性。
各孔数值减去空白对照后,以检测的吸光度(OD490)为纵坐标,LDH酶活力(mU)为横坐标,绘制LDH标准曲线。同时计算出该趋势线的公式。
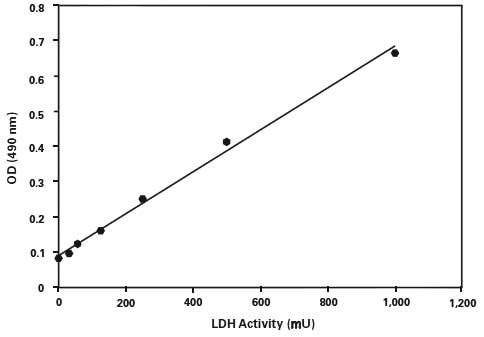
A490nm=k×LDH酶活力单位(mU)+b,通过Excel等软件计算 出趋势线的斜率k和截距b。
根据上述公式计算样品中LDH活力。
样品实际吸光度(OD490)=样品孔测得的吸光度-背景空白对照孔吸光度
检测体系中LDH酶活力单位(mU)=(OD490-b)/k
样品中LDH酶活力(mU/ml)=检测体系中LDH酶活力单位(mU )/检测样品体积