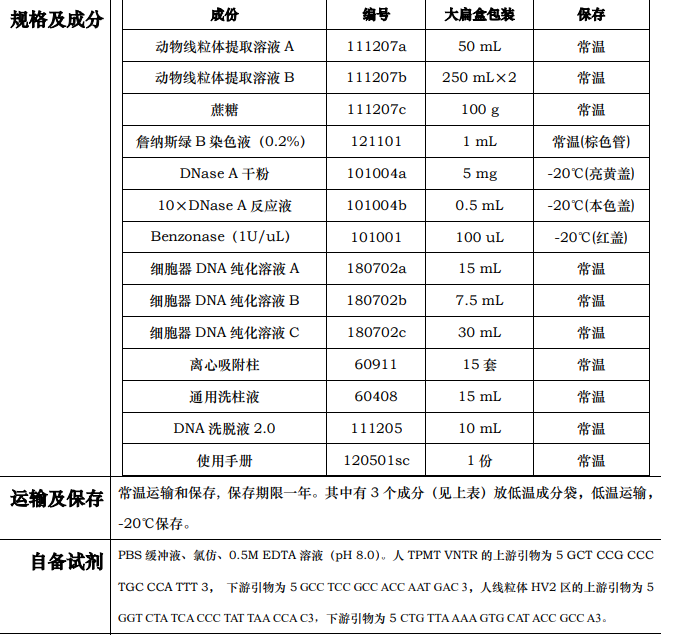
1. 将 50mL 溶液 A 和 250mL 溶液 B 放冰上预冷待用。
2. 配制 1.0M 低比重溶液 100mL: 将 34 克蔗糖用 100mL 溶液 B 溶解并放冰上待用。
3. 配制线粒体重悬液 100mL: 将 75 mL 溶液 B 和 25 mL1.0M 低比重溶液混合,冰上待用。
二:线粒体粗提
4. 如果提取材料是单层培养细胞,先用 20 mL 自备的 PBS 缓冲液洗涤 1×108个培养的单层细胞,
共洗涤 2 次。然后用塑料刮匙刮下细胞,重悬在 20 mL PBS 缓冲液中。如果是悬浮细胞,则 1000g
4℃离心 10 分钟收集 1×108个细胞,再用 20 mL PBS 缓冲液洗涤 2 次,最后将细胞重悬在 20
mL PBS 缓冲液中。
5. 用平甩转子(swinging-bucket rotor)离心机 1000 g 4℃离心 10 分钟,弃上清留沉淀。
6. 加入 5 倍体积(以细胞沉淀的体积为基数)的预冷的溶液 A,轻柔重悬细胞。
7. 冰上放置 4-5 分钟。注意:冰浴时间不要超过 5 分钟。
8. 如果是成纤维细胞,由于其难以裂解,可将细胞重悬液在-80℃放置 20-30 分钟后再化冻,然后
进入下步操作。如果不是成纤维细胞,则直接进入下步操作。
9. 将细胞重悬液体转移到预冷的 Dounce 玻璃匀浆器中(工作体积为 10-15 mL,间隙为 0.12 mm,
最好是玻璃材质,否则线粒体产率会降低)匀浆适当次数。细胞株不同,其最适匀浆次数不同,
一般需要 40 次-60 次左右。匀浆是线粒体纯化最关键的步骤,故匀浆前最好先通过预实验确定最
适匀浆次数,方法是每匀浆 5-10 次后,取 2-3 uL 匀浆液到载玻片上,然后在相差显微镜下观察,
完整细胞数量降低到 20%以下为佳。
10. 加入 1/3 体积的、预冷的 1.0 M 低比重溶液,轻柔混匀。
11. 用平甩转子离心机 4℃1000 g 离心 10 分钟。沉淀含残留完整细胞、细胞碎片和细胞核,上清液
含线粒体。
12. 转移上清液到离心管中,冰上放置。在显微镜下检测上清液中线粒体的完整性。具体做法是先滴
50uL 左右上清液到载玻片上,再滴入 50 uL 詹纳斯染液绿 B 染色液 20 分钟,油镜下观察,蓝
绿色颗粒状物即为线粒体。
13. 用固定角度转子(fixed-angle rotor)离心机 4℃15,000 g 离心 15 分钟,弃上清,所得棕黑色
沉淀即为粗提线粒体沉淀。
14. 用 5 mL 线粒体重悬液重悬线粒体,4℃15,000 g 离心 15 分钟,弃上清。
15. 重复上步一次。
16. 如果后续实验是提取 mtDNA 用于 PCR 或 Southern 杂交,则直接进入第 4 部分 mtDNA 提取,
也可以放-80℃长期保存待用。如果后续实验是提取 mtDNA 用于高通量测序,则必须彻底降解掉
其中的细胞核 DNA 污染。匀浆过程中一个破裂的细胞核释放出的 DNA 相当于上百万个线粒体的
DNA 量之合,所以无论如何小心,粗提线粒体中必有大量的细胞核 DNA 污染,如果不将其清除,
高通量测得的序列将绝大部分来于核 DNA 而非 mtDNA。
三:细胞核 DNA 的去除及鉴定
17. 将线粒体重悬于 0.3 mL 预冷的线粒体重悬液中,取 10 uL 作为未处理线粒体(后面将使用)。
18. 加入 6 uL Benzonase(1U/uL)溶液和 30 uL DNase A 溶液(配法:将 0.5 mL 10×DNase
A 反应液加到装有 5 mg DNase A 干粉的离心管中得到 10 mg/mL DNase A 溶液,未用完的此
溶液需要分装后放-20℃保存)。
19. 37℃保温一段时间酶切细胞核 DNA。注意:最好先预实验,每隔一段时间取 10 uL 样品,灭活
其中的 DNase 后作为模板用 PCR 扩增人基因组 TPMT VNTR 位点和人 mtDNA HV2 区(两基因
的 PCR 引物见自备试剂),检测不到 VNTR 基因而能检测到 mtDNA 基因的处理时间为最佳。相
关引物和 PCR 试剂需要自备。可用未处理线粒体做对照。
20. 加入 10 uL 自备的 0.5M EDTA 溶液(pH 8.0)以终止酶反应。詹纳斯绿 B 染色并在显微镜下
检查线粒体完整性(操作见上)。
21. 4℃10,000 g 离心 10 分钟,弃上清。
22. 用 1 mL 的预冷线粒体重悬液重悬线粒体后,4℃10,000 g 离心 10 分钟,弃上清留沉淀。
23. 重复上步操作,最后得到无基因组 DNA 污染的线粒体沉淀。
四:线粒体 DNA 提取
24. 在线粒体沉淀中加入 600uL 预热的细胞器 DNA 纯化溶液 A 到线粒体沉淀中,充分吹打均匀。
25. 再加入 300 uL 预热的细胞器 DNA 纯化溶液 B 到离心管中(此溶液粘稠,需要预热到 65℃取用),
颠倒数次混匀。此时溶液中可能有白色丝状悬浮物产生。
26. 65℃放置 5 分钟。
27. 加入 200 uL 自备氯仿,震荡混匀 10-30 秒,此时溶液将呈乳白色。
28. 12,000g 室温离心 2 分钟。此时上清液将变得透明,中间层有白膜。小心转移上清液到一个新的
1.5 mL 塑料离心管中,避免触及中间的白膜。
29. 加入 1.5 倍体积的细胞器 DNA 纯化溶液 C,颠倒混匀后转移到离心吸附柱中,静置 2 分钟。
30. 12,000 g 室温离心 1 分钟,弃收集管中的穿透液。
31. 将 0.5 mL 通用洗柱液加入离心柱中,12,000g 室温离心 1 分钟,弃穿透液。
32. 重复上步操作一次。
33. 空甩半分钟去除残留液体,将离心吸附柱转移到新的 1.5 mL 离心管中。
34. 加 30-50 uL DNA 洗脱液 2.0,室温放置 3-5 分钟。
35. 12,000 g 室温离心 1 分钟即得纯化的 mtDNA 溶液,立即使用或放-20℃长期保存。