一、 技术概述
本技术文章旨在描述利用CRISPR-Cas9基因编辑技术在293T细胞中构建hSMPD1基因敲除株的实验流程和关键参数。hSMPD1基因编码酸性鞘磷脂酶,该酶在细胞代谢和信号传导中发挥重要作用。构建hSMPD1基因敲除株有助于研究该基因的功能及其在相关疾病中的作用。
二、 细胞背景
-
细胞名称: 293T细胞
-
细胞类型: 人胚胎肾细胞,经SV40大T抗原转染
-
细胞特性: 易于转染,高水平表达外源蛋白
-
应用领域: 病毒包装,蛋白表达,基因功能研究
三、 培养条件
-
培养基: DMEM高糖培养基,添加10%胎牛血清(FBS),1%青霉素-链霉素
-
培养条件: 37°C,5% CO2,饱和湿度
-
传代比例: 1:3至1:6,每2-3天传代一次
四、 修饰类型
-
基因修饰类型: hSMPD1基因敲除
-
基因ID: ENSG00000166333
-
目标位点: 根据实验设计选择hSMPD1基因的特定外显子区域进行敲除
五、 转导方法
-
CRISPR-Cas9系统: 使用质粒或病毒载体将Cas9蛋白和靶向hSMPD1基因的sgRNA导入293T细胞
-
转染试剂: 根据实验需求选择合适的转染试剂,例如Lipofectamine 3000
-
转染步骤: 按照转染试剂说明书进行操作,优化转染条件以获得较高的敲除效率
六、 克隆类型
-
单克隆筛选: 通过有限稀释法或流式细胞分选技术获得单克隆细胞株
-
基因型鉴定: 使用PCR、测序等方法鉴定hSMPD1基因敲除情况
-
蛋白表达检测: 使用Western blot等方法检测hSMPD1蛋白表达水平,验证敲除效果
八、收货当天如何处理细胞?
收到细胞后请务必仔细阅读产品资料,了解细胞相关信息,如贴壁特性 (贴壁/悬浮/半贴壁半悬浮)、细胞形态、培养体系、传代比例和换液频率等。
| T25培养瓶常温运送
1. 收到细胞后,请先检查培养瓶是否完好,培养基是否外渗、浑浊,并核对瓶身上的标签信息、细胞数量是否与发货清单一致。如有异常情况,及时与我们联系。
注:培养瓶内飘浮的小体积絮状物可能是脱落的细胞,对于这种情况,建议在细胞培养箱静置2 h 后再观察,如仍有细胞未贴壁,可收集培养上清离心后再接种到原瓶或新的培养容器中。
2. 用75%酒精消毒细胞培养瓶表面,不要打开培养瓶,将细胞平放于细胞培养箱内静置1~2 h,待细胞恢复基本生长状态后,再进行后续操作。
3. 显微镜下观察细胞状态,观察细胞时请拍摄清晰的100×、200×照片各2~3张留存。
4. 细胞种类不同,细胞的运输液不同。请根据培养瓶上的标识判断培养瓶内培养基是否可以继续使用。
5. 若细胞密度低于80%,请及时更换为预热的完全培养基培养。若细胞密度大于80%,可进行传代。具体见《细胞培养操作说明》。
| 冻存管干冰运送
1. 收到细胞后,请先检查包装是否完整,干冰是否充足,冻存管有无破损等情况,并核对冻存管上的标签信息、细胞管数是否与发货清单一致。如有异常情况,及时与我们联系。
2. 低温保存的细胞非常脆弱,细胞收到后如在24 h内复苏,可存放于-80℃冰箱;超过24 h请存放于液氮中。建议尽快复苏,具体复苏操作见《细胞培养操作说明》。
3. 复苏细胞后,首次换液之前需在显微镜下观察细胞状态,观察细胞时请拍摄清晰的100×、200×照片各2~3张留存。
4. 部分细胞贴壁时间较长,请根据说明书进行操作。若复苏有异常,及时与我们联系。
5. 后续根据细胞汇合度继续培养或消化传代。
| 血清管常温运送
1. 在收到细胞后,请先检查试剂管是否完好,培养基是否外渗,并核对试剂管上的标签信息、细胞管数是否与发货清单一致。如有异常情况,及时与我们联系。
2. 收到细胞后请尽快进行处理,如不能及时处理,请将细胞放至常温环境,通常15~25℃为佳,并尽量在24 h内处理。血清管细胞悬液可能会呈现一定程度的浑浊,属于正常现象,可放心操作。
3. 用75%酒精消毒血清管表面,在洁净工作台内小心开盖,尽量避免气泡溢出,轻柔吹打数次,转移至15 mL离心管中。
4. 吸取1 mL预热的完全培养基清洗血清管内壁,同样转移至15 mL离心管,并吹打均匀。
5. 250 g离心4 min。离心后去除上清,加入适量预热的完全培养基重悬后接种至合适大小的培养容器中,放置于培养箱内进行培养。
6. 首次换液前需在显微镜下观察细胞状态,观察细胞时请拍摄清晰的100×、200×照片各2~3张留存。
7. 后续根据汇合度继续培养或消化传代。具体见《细胞培养操作说明》。
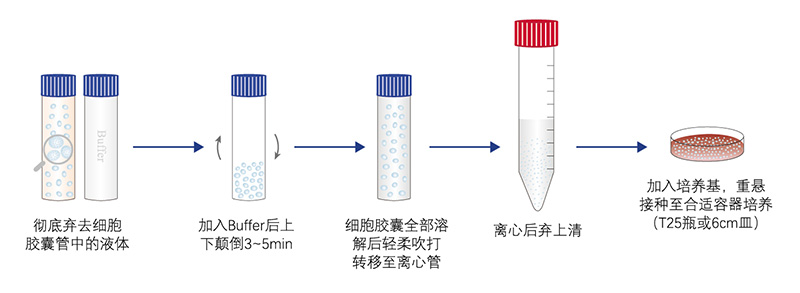
| 细胞胶囊技术
1. “细胞胶囊”包括细胞管和溶解Buffer共2个试剂管。收到细胞后,请先检查试剂管是否完好,培养基是否外渗,并核对管身上的标签信息、细胞数量是否与发货清单一致。如有异常情况,及时与我们联系。
2. 收到“细胞胶囊”后需尽快处理, 如不能及时处理, 请将细胞放至常温环境, 通常15~25℃为佳,并尽量在24 h内处理。“细胞胶囊”管内的液体肉眼观察可能会呈现一定程度的浑浊,这属于正常现象,可放心操作。
3. 用75%酒精消毒试剂管表面,在洁净工作台内小心的打开细胞胶囊管盖,尽量避免气泡溢出。
4. 小心弃去细胞胶囊管中的全部液体。
5. 将溶解Buffer全部加入到细胞胶囊管中,拧紧管盖,上下颠倒3~5 min。观察到球状的细胞胶囊完全溶解后,小心开盖,使用移液枪轻柔吹打数次,将所有液体转移到15 mL离心管内。
7. 250 g离心4 min。离心后去上清,加入适量预热完全培养基重悬后,将细胞悬液接种到合适大小的培养容器中(T25瓶或6cm皿),放置于细胞培养箱中培养。
8. 首次换液前需在显微镜下观察细胞状态,观察细胞时请拍摄清晰的100×、200×照片各2~3张留存。如有异常情况,及时与我们联系。
9. 后续根据细胞汇合度继续培养或消化传代。具体见《细胞培养操作说明》。