背景简介
二十世纪七十年代,Friedenstein首次从骨髓中分离出一种多能基质细胞,呈梭形,可以进行体外克隆和多向分化,被称为CFU-Fs(colony-forming unit fibro-blasts)。随后,这种骨髓来源的基质细胞被进一步发现是间叶组织细胞谱系的共同前体细胞,因其具有干细胞的部分特性,而被命名为骨髓间充质干细胞(BMSCs)。
BMSCs来源方便,易于分离、培养、扩增和纯化,多次传代扩增后仍具有干细胞特性,免疫原性低。但是不同的分离培养方法使得BMSCs在体外扩增时的纯度、活性、表型和分化潜能差异很大,导致基础研究结论各异和临床试验效果不一。因此,深入认识BMSCs不同分离方法和培养条件的优缺点,并根据实验目的做出相应选择,是进行BMSCs实验研究的关键环节。
目前用于分离BMSCs的方法主要有五种,分别是贴壁筛选法、骨组织消化法、密度梯度离心法、流式细胞仪分离法和磁珠分选法。
贴壁筛选法是利用细胞贴壁时间及贴壁牢固性的不同,逐步将非贴壁细胞和其它杂质细胞去除的一种简单易行的方法,常用于干细胞的培养中,因此用于分离BMSCs最为广泛。
利用BMSCs贴壁生长特性,更换培养液逐步去除漂浮生长的造血系统细胞即可获得较纯化的BMSCs;而且骨髓中的造血干细胞能分泌生长因子和促贴壁物质,可促进BMSCs贴壁生长,贴壁筛选法也常被称为直接培养法或者全骨髓法。
对初次培养者来说,贴壁法分离BMSCs操作简单易掌握,不易发生污染,是一个较好的分离方法。
准备工作
1. 6孔板,移液器,巴式管,1ml注射器,细胞培养箱,超净工作台,低速离心机,4℃冰箱,-80℃冰箱,细胞冻存管,T25细胞培养瓶,眼科剪,尖头镊
2. 分离BMSC所需的试剂有间充质干细胞基础培养基,胎牛血清,DMSO,双抗,PBS , 0.25%胰酶,无血清细胞冻存液,
分离过程
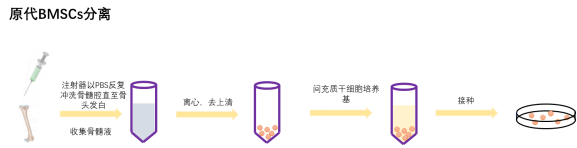
1. 以颈椎脱臼法处死SPF级出生1-3D(最大也可至4周龄)C57BL/6J小鼠或者SD/Wistar大鼠,用75%乙醇浸泡。
2. 随后在鼠的腿的位置剪开外皮和内皮,无菌状态下取出双侧股骨和胫骨,浸泡于无菌含双抗PBS溶液中。剔除股骨和胫骨周围的肌肉、结缔组织,用含双抗的PBS溶液清洗三遍。
3. 用眼科剪剪去股骨和胫骨的两端,暴露骨髓腔。
4. 用注射器以PBS反复冲洗骨髓腔直至骨头发白。
5. 收集骨髓液,过40μM细胞筛。
6. 收集过滤骨髓液,离心,后加入培养基接种于培养基皿中置于37℃,5% CO2,饱和湿度的细胞培养箱中培养。
7. 24-48h后去悬浮,接下来的每3天换液一次,直到需要传代。
注意事项
1. 全程无菌操作,鼠要提前酒精浸泡防止污染,仔细剥离去除血管和筋膜组织。
2. 剪开皮肤的剪刀需与取材的剪刀相区分,避免污染。
大鼠/小鼠骨髓间充质干细胞鉴定
1. 形态学观察
原代培养后,传代2-3次,BMSCs呈现单层,梭状或多枝状的细胞形态,其直径在25-30um,待细胞达到汇合时,它们形态上呈纺锤形,类似于成纤维细胞,贴壁较牢固。
2. 标记物检测
一般的标准为CD29、CD44、CD73、CD105为阳性(>90%);CD34、CD45、CD11b为阴性(<5%)。
3. 诱导分化实验
在特定的诱导条件下,脂肪间充质干细胞可以分化为成骨细胞、软骨细胞、脂肪细胞、神经细胞、上皮细胞、心肌细胞等多种细胞。看
