MDCK细胞准备工作
准备工作对开展MDCK细胞培养异常重要,工作量也较大,应给予足够的重视,准备工作中某一环节的疏忽可导致实验失败或无法进行。准备工作的内容包括器皿的清洗、干燥与消毒,培养基与其他试剂的配制、分装及灭菌,无菌室或超净台的清洁与消毒,培养箱及其他仪器的检查与调试,具体内容可参阅有关文献。
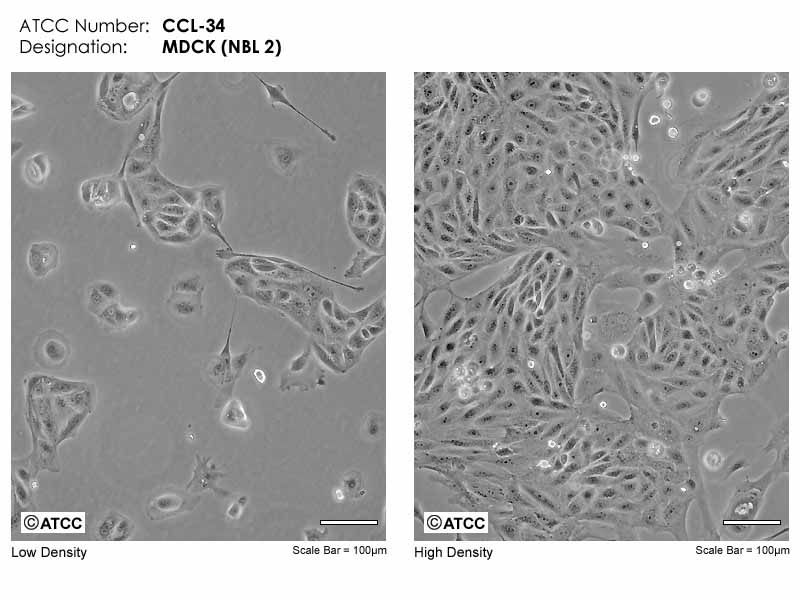
ATCC细胞库MDCK细胞图片
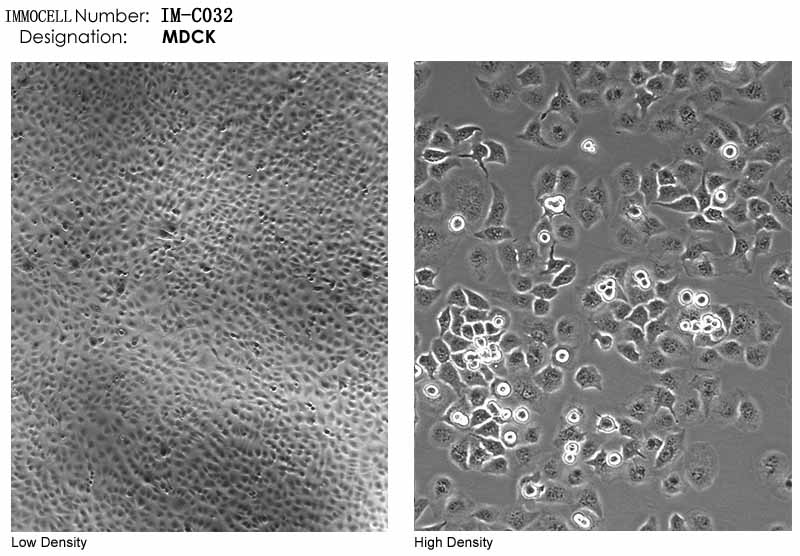
细胞库MDCK细胞图片
MDCK细胞培养实验准备
提前开启紫外照射30min消毒灭菌,工作台开灯通风10min,用75%酒精擦拭台面。
器材耗材:玻璃瓶、培养瓶、培养皿、巴士管、离心管、移液枪、枪头(白色0-10ul;黄色20-200ul;蓝色100-1000ul)、滤器、吸管、多孔培养皿、6cm皿、10cm皿,培养瓶等。
试剂:MEM培养液、缓冲液、PBS、消化液、血清、抗生素。
MDCK细胞背景简介
MDCK细胞系(MDCK CELL LINES)是S.H.MADIN于1958年9月建成,来源于考克斯班尼犬肾脏,该肾脏细胞原代培养时其形态类似于成纤维细胞,经过胰蛋白酶和EDTA混合消化液的连续6次消化法纯化而上皮样细胞,每次纯化间隔时间为7D。培养中MDCK细胞具有远段肾小管与集合管,来源细胞的分化特性。MDCK细胞株至少有两种细胞类型,一种命名为C5A,其在含I型胶原的培养物中生长时,能分泌液体,导致囊肿形成,但在塑料面的培养低物上培养时,能分泌液体,却不能形成囊肿,另一种细胞正好相反。
MDCK细胞培养条件
培养基:MEM(ATCC改良)+10%FBS+PS
生长条件:气相:95%空气+5%二氧化碳;温度:37℃
传代方法:1:2至1:3,每周 2-3次
冻存条件:无血清冻存液(或者冷冻保存液:90%血清,10%DMSO,现用现配),液氮储存
消化时间:1-3min(视细胞情况而定)
MDCK细胞培养注意事项
1.运输用的培养基(灌液培养基)不能再用来培养MDCK细胞,请按照说明书细胞培养条件新配制的完全培养基来培养细胞。
2.MDCK细胞首次传代建议1:2传代就是1个T25瓶传2个T25瓶或者2个6cm皿,不是1个T25瓶传2个10cm皿。
MDCK细胞培养操作
MDCK细胞复苏步骤
1.将含有1 mL MDCK犬肾细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀;
2.在1000 rpm条件下离心4 min,弃去上清液,加1-2 mL培养基后吹匀;
3.将所有MDCK犬肾细胞胞悬液加入含适量培养基的培养瓶中培养过夜(或将细胞悬液加入6cm皿中,加入约4 mL培养基,培养过夜);
4.第二天换液并检查MDCK细胞密度。
MDCK细胞传代步骤
如果MDCK细胞密度达80%-90%,即可进行传代培养。
1.弃去培养上清,用不含钙、镁离子的PBS润洗MDCK细胞1-2次。
2.加1 mL消化液(0.25%Trypsin-0.02% EDTA)于培养瓶中,使消化液浸润所有MDCK细胞,将培养瓶置于37℃培养箱中消化1-3min(视细胞情况而定),然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加2-3ml完全培养基终止消化。轻轻打匀后装入无菌离心管中,1000 rpm离心5 min,弃去上清液,补加1-2 mL培养液后吹匀。
3.将MDCK细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,置于培养箱中培养。
MDCK细胞冻存方法
待MDCK细胞生长状态良好时,可进行细胞冻存。下面 T25 瓶为例;
1.收集MDCK细胞及细胞培养液,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
2.根据MDCK细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液,注意冻存管做好标识。
3.将冻存管放入-80℃冰箱,24 h后转入液氮灌储存。记录冻存管位置以便下次拿取。
MDCK细胞应用
MDCK细胞被广泛用作远曲小管或集合管的模型,还可用于代谢研究和Pg级药物与药物相互作用研究以及观察流感病毒株对细胞功能的影响。
MDCK细胞系(MDCK Cell Lines)广泛用于多种病毒的扩增和纯化,如:(呼肠孤病毒、腺病毒、 犬细小病毒、猫粒细胞缺乏症病毒)及禽流感病毒等。由于其病毒感染效率高、增殖快,且不易变异,MDCK细胞系被公认为最适于甲、乙型流感病毒疫苗生产的3种细胞系之一。
传统的MDCK细胞培养大多采用有血清贴壁培养方式。血清是由血浆去除纤维蛋白而形成的一种复杂混合物,其含有细胞生长所需的生长因子、激素、载体蛋白、贴壁因子、微量元素以及其他营养物质,可以有效地促进细胞生长和产物表达。
用于基于MDCK细胞高密度培养的甲型流感病毒疫苗生产工艺开发与优化研究;
通过考察微载体和血清对细胞生长的影响以及感染参数对病毒生产效率的影响,确定了基于MDCK细胞培养的流感疫苗生产的基本工艺。
研究表明,Cytodex-1和Cytodex-3两种微载体均能支持MDCK细胞正常贴附生长,胎牛血清(FBS)支持细胞生长的作用显著优于新生小牛血清(NBS)。以2 g/L浓度的Cytodex-1或3 g/L的Cytodex-3为贴附基质,以DMEM为基础培养基,添加7.5%(v/v)的FBS便能确保MDCK细胞正常生长,细胞密度可达5.50×106 cells/ml;事关流感病毒感染复制的三个关键参数TPCK-胰酶浓度、MOI和TOI均对病毒增殖具有显著影响,采用5.0 mg/L的TPCK-胰酶浓度、0.01的MOI和72 h的TOI较为适宜;据此建立了基于MDCK细胞生物反应器培养的流感病毒基本生产工艺,流感病毒HA滴度值达到210.13±0.18 HA units/50μl,单位细胞病毒产率Svy为(6.09±0.44)×103virions/cell。
上述生产工艺虽可满足工业化生产的基本需求,但其生产效率仍有较大提升空间。为了进一步提高生产效率,本文继而通过考察维持培养基的关键组分对产毒期MDCK细胞密度维持、代谢和病毒增殖的影响,分析了病毒增殖过程对营养代谢的需求,进一步优化了维持培养基。
研究表明产毒期的换液操作可显著提高单位细胞的病毒产率,由此可知在细胞产毒阶段改善培养环境的营养供给对病毒高效增殖尤为重要。
